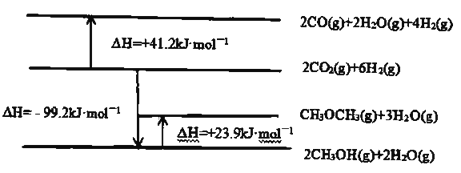
题目内容
【题目】根据反应4NH3+5O2=4NO+6H2O,回答下列问题:
(1)该反应中氧化剂是_______________,被氧化的是_________元素。
(2)该反应中氧化剂与还原剂的物质的量之比为______________。
(3)若反应中转移了10mol电子,则生成的NO在标准状况下的体积为_________。
(4)用单线桥法标出电子转移的方向与数目 ____________。
【答案】O2, N 5:4 44.8L ![]()
【解析】
(1)该反应中氮元素的化合价从-3价升高到+2价,氧元素的化合价从0价降低到-2价,因此氧化剂是![]() ,被氧化的是氮元素;
,被氧化的是氮元素;
(2)![]() 中的氮元素化合价全部升高,
中的氮元素化合价全部升高,![]() 中的氧元素的化合价全部降低,因此氧化剂和还原剂的物质的量之比就是其化学计量数之比,即5:4;
中的氧元素的化合价全部降低,因此氧化剂和还原剂的物质的量之比就是其化学计量数之比,即5:4;
(3)由反应方程式可以看出,当生成4mol![]() 时,一共转移了5mol×4=20mol电子,也就是说生成
时,一共转移了5mol×4=20mol电子,也就是说生成![]() 数和转移电子数为1:5,故当转移10mol电子时可以生成2mol
数和转移电子数为1:5,故当转移10mol电子时可以生成2mol![]() ,
,![]() 在标况下的体积为22.4L/mol×2mol=44.8L;
在标况下的体积为22.4L/mol×2mol=44.8L;
(4)单线桥即从失电子的物质指向得电子的物质,由上一问可知一共转移了20个电子,据此画出单线桥:![]() 。
。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目