��Ŀ����
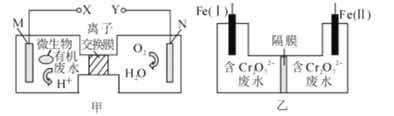
����Ŀ���й����غϳ���(����)ʹ��������Ϊŷ�����ҵ�1/4��Ϊ�˱��������о�Ժ��ij������ʴ���̽����о����ó����и�ʴ������

(1)H2S���Ժϳ����ص���Ȼ������380K�����Ϊ2L���ܱ������У����ڷ�Ӧ��H2(g)��S(s)![]() H2S(g) ��H����21.6 kJ��mol��1����Ӧ�ﵽƽ��ʱ��H2��S��H2S�����ʵ�����Ϊ3 mol��
H2S(g) ��H����21.6 kJ��mol��1����Ӧ�ﵽƽ��ʱ��H2��S��H2S�����ʵ�����Ϊ3 mol��
��380Kʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ__________��
�����жԸ÷�Ӧ������ȷ����_________(�����)��

(2)��ӦII�Ļ�ѧ����ʽΪ��____________________________________��
(3)��֪������H2S2O3��K1��2.2��10��1��K2��2.5��10��2��
��Na2S2O3ˮ��Һ�е���غ�ʽΪ___________________________��
�ڷ�ӦIV�Ļ�ѧ����ʽ_____________________________________���÷�Ӧ_________(������������������)˵��FeS�ܽ���ǿ��FeS2O3��
(4)�����������ո�ʴ����Ϊ__________________��Ϊ����Ч���������ֽ������������������CuSO4��Һ������(H2S)�������ӷ�Ӧ����ʽΪ_________��(�����£�H2S��K1��1.3��10��7��K2��7.1��10��15��CuS��Ksp��6.3��10��36)
���𰸡�1 ab 4FeS��7O2��2Fe2O3��4SO2 c(Na��)��c(H��)��2c(S2O32��)��c(HS2O3��)��c(OH��) FeS��H2S2O3��H2S����FeS2O3 ���� Fe2O3��FeS2O3 Cu2����H2S��CuS����2H��
��������
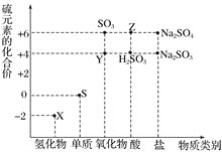
����ƽ�ⳣ���Ĺ�ʽ���м��㣬���岻���룻�÷�Ӧ����Ӧ�����ȷ�Ӧ���¶�����ƽ��������Ӧ�ƶ�������ѹǿƽ�ⲻ�ƶ��������������С�������Ũ�����������¶ȷ�Ӧ���ʼӿ죻���������Ũ�ȣ���ЧΪ����ѹǿ�����ݷ�Ӧ����ͼ��֪����ӦII��Ҫ��Ӧ����O2��FeS����Ҫ������SO2��Fe2O3���ٸ��ݵ�ʧ�����غ���ƽ���̣���ӦII�ͷ�ӦIV�����ղ�����Fe2O3��FeS2O3������������ͭ��Ӧ������ͭ���������ᣬ�൱��ǿ�����ķ�Ӧ��
(1) �ٸ���ƽ�ⳣ���Ĺ�ʽ���м��㣬���岻���룬�ʸ÷�Ӧ��ƽ�ⳣ��K= ![]() =
= ![]() =1���ڸ÷�Ӧ����Ӧ�����ȷ�Ӧ���¶�����ƽ��������Ӧ�ƶ���ƽ�ⳣ������ͼ����ʵ������ϣ�����ѹǿƽ�ⲻ�ƶ��������������С�������Ũ�����������¶ȷ�Ӧ���ʼӿ죬ͼ��������Ӧ���ʲ��䣻���������Ũ�ȣ���ЧΪ����ѹǿ��ƽ�ⲻ�ƶ�������ֵĺ������䣬ͼ����ʵ�ʲ������H2S2O3�������ᣬ����Һ�д��ڵ�������Na����H����S2O32����HS2O3����OH������ӦIV����Ҫ��Ӧ����H2S2O3��FeS����Ҫ������H2S��FeS2O3��
=1���ڸ÷�Ӧ����Ӧ�����ȷ�Ӧ���¶�����ƽ��������Ӧ�ƶ���ƽ�ⳣ������ͼ����ʵ������ϣ�����ѹǿƽ�ⲻ�ƶ��������������С�������Ũ�����������¶ȷ�Ӧ���ʼӿ죬ͼ��������Ӧ���ʲ��䣻���������Ũ�ȣ���ЧΪ����ѹǿ��ƽ�ⲻ�ƶ�������ֵĺ������䣬ͼ����ʵ�ʲ������H2S2O3�������ᣬ����Һ�д��ڵ�������Na����H����S2O32����HS2O3����OH������ӦIV����Ҫ��Ӧ����H2S2O3��FeS����Ҫ������H2S��FeS2O3��
�ʴ�Ϊ��1��ab��
(2)���ݷ�Ӧ����ͼ��֪����ӦII��Ҫ��Ӧ����O2��FeS����Ҫ������SO2��Fe2O3���ٸ��ݵ�ʧ�����غ���ƽ���̣��ɵã�4FeS��7O2��2Fe2O3��4SO2��
�ʴ�Ϊ��4FeS��7O2��2Fe2O3��4SO2��
(3)����غ㣺��Һ�����������ӵĵ�����������������ӵĸ���������ɵ���ƽ�ⳣ����֪��H2S2O3�������ᣬ����Һ�д��ڵ�������Na����H����S2O32����HS2O3����OH�������е���غ㣺c(Na��)��c(H��)��2c(S2O32��)��c(HS2O3��)��c(OH��)�����ݷ�Ӧ����ͼ��֪����ӦIV����Ҫ��Ӧ����H2S2O3��FeS����Ҫ������H2S��FeS2O3������д����ӦIV�Ļ�ѧ����ʽΪ��FeS��H2S2O3��H2S����FeS2O3ѧ���÷�Ӧ���ڸ��ֽⷴӦ������˵�����ߵ��ܽ�ȴ�С��
�ʴ�Ϊ��c(Na��)��c(H��)��2c(S2O32��)��c(HS2O3��)��c(OH��)�� FeS��H2S2O3��H2S����FeS2O3�����ܣ�
(4)������ͼ��֪����ӦII�ͷ�ӦIV�����ղ�����Fe2O3��FeS2O3���ʴ����������ո�ʴ����ΪΪFe2O3��FeS2O3������������ͭ��Ӧ������ͭ���������ᣬ�൱��ǿ�����ķ�Ӧ����Ӧ���ӷ���ʽΪ��Cu2++H2S=CuS��+2H+��
�ʴ�Ϊ��Fe2O3��FeS2O3��Cu2++H2S=CuS��+2H+��