��Ŀ����
����Ŀ���������ȼ��仯����Ի���������Ҫ��Ӱ�죬�ڻ����������ճ������е���;Ҳʮ�ֹ㷺��������Ư������������ũҩ�����ʵȣ�
��1����N2 ��H2 Ϊԭ�Ϻϳ������ķ�ӦΪ��N2��g��+3H2��g��2NH3��g����H=QkJ��mol��1 �� ��֪N��N ������Ϊ946kJ��mol��1 �� H��H������Ϊ436kJ��mol ��1 �� N��H������Ϊ391kJ��mol��1 �� ��Q= ��
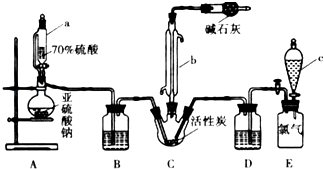
��2���������Ϊ560mL����״���£���SO2 ��Cl2 ͬʱ����ͨˮ�У��õ�1.0L��Һ������ҺpH= ��
��3�����ʵ���Ũ����ȵ�NH4HSO3��Һ��NaHSO3��Һ�У������ӵĵ���̶Ƚ�С�������ѧʽ����ԭ����
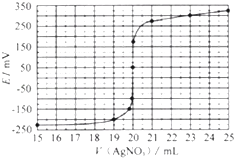
��4���ö��Ե缫���NaHSO3 ��Һ��װ����ͼ��ʾ����I�����ѧʽ����ͬ�����������ų��Ļ������ijɷ�Ϊ �� 
��5����ˮ��һ�ֳ����ij���������1.0L2.0��10��4mol��L��1��MgCl2 ��Һ��ͨ�� ����������Һ����ı仯�����а�ɫ�������ɣ�
��д�����ɰ�ɫ���������ӷ���ʽ
�ڵ���Ӧ�п�ʼ�а�ɫ��������ʱ��ͨ�˵��������״����Ϊ mL������֪ʵ��������NH3 �� H2O�ĵ���ƽ�ⳣ��Ϊ1.8��l0��5 �� Ksp[Mg��OH��2]=1.8��10��11��
���𰸡�
��1����92
��2��1
��3��NH4HSO3��笠�����ˮ������ԣ�����������������ӵĵ���
��4��Na2SO3��O2��SO2
��5��Mg2++2NH3?H2O=Mg��OH��2��+2NH4+��118.72
���������⣺(1)��H=��Ӧ��ļ���֮�ͩ�������ļ���֮��=��946kJ��mol��1��+3����436kJ��mol ��1����6����391kJ��mol��1��=��92kJ��mol��1 ��
���Դ��ǣ���92��
��2.��n��SO2��=n��Cl2��= ![]() =0.025mol��
=0.025mol��
�����SO2��Cl2 ͬʱ����ͨˮ�з���Cl2+SO2+2H2O=H2SO4+2HCl��������n��H+��=0.025mol��4=0.1mol��c��H+��= ![]() =0.1mol/L��
=0.1mol/L��
pH=��lg0.1=1��
���Դ��ǣ�1��
��3.��NH4HSO3��Һ笠�����ˮ������ԣ�����������������ӵĵ��룬�������ӵĵ���̶Ƚ�С����NH4HSO3 ��
���Դ��ǣ�NH4HSO3��笠�����ˮ������ԣ�����������������ӵĵ��룻
��4.����������������ͬʱ����OH�� �� ��NaHSO3��Һ��Ӧ����Na2SO3 �� ��������������ͬʱ����H+ �� ��NaHSO3��Ӧ����SO2 ��
���Դ��ǣ�Na2SO3��O2��SO2��
��5.���ٰ�ˮ��Һ�ʼ��ԣ���MgCl2 ��Һ��Ӧ����������þ��������Ӧ�����ӷ���ʽΪMg2++2NH3H2O=Mg��OH��2��+2NH4+ ��
���Դ��ǣ�Mg2++2NH3H2O=Mg��OH��2��+2NH4+��
�ڿ�ʼ�а�ɫ��������ʱ��c��OH����= ![]() mol/L=3��l0��4mol/L��
mol/L=3��l0��4mol/L��
��ϰ�ˮ�ĵ���ƽ�ⳣ��= ![]() =
= ![]() =1.8��l0��5 �� c��NH3 �� H2O��=5��l0��3mol/L��
=1.8��l0��5 �� c��NH3 �� H2O��=5��l0��3mol/L��
δ����ǰc��NH3 �� H2O��=5��l0��3mol/L+3��l0��4mol/L=5.3��l0��3mol/L��
n��NH3��=5.3��l0��3mol��
ͨ�백�������=5.3��l0��3mol/L��22.4L/mol=0.11872L=118.72mL��
���Դ��ǣ�118.72��
�����㾫����������Ŀ����֪���������÷�Ӧ�Ⱥ��ʱ�����֪ʶ���Եõ�����Ĵ𰸣���Ҫ�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ�

 ����С��ʿ���������ϵ�д�
����С��ʿ���������ϵ�д�