题目内容
【题目】在密闭容器中发生反应N2O4(g)2NO2(g)△H=+57kJmol﹣1 , 在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( ) 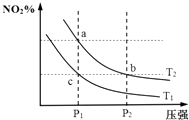
A.反应温度:T1>T2
B.a、b两点的平衡常数:Kb>Ka
C.a、c两点气体的颜色:a浅,c深
D.b、c两点的反应速率:v(b)>v(c)
【答案】D
【解析】解:A.升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,a点NO2的体积分数大,则T1<T2 , 故A错误;
B.a、b两点的处于等温线上,所以平衡常数相等,Kb=Ka , 故B错误;
C.a、c两点气体的颜色,a的二氧化氮的体积分数大于c点:a深,c浅,故C错误;
D.b的温度高压强大,所以b、c两点的反应速率:v(b)>v(c),故D正确;
故选D.
【考点精析】利用化学平衡状态本质及特征对题目进行判断即可得到答案,需要熟知化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

 阅读快车系列答案
阅读快车系列答案【题目】A、B、C、D、E、F六种短周期元素的简单离子都含有10个电子,且对应元素化合价与原子序数的关系如图所示。

(1)将A、E两种元素的元素符号填入下表中正确的位置上。________
族序数 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | ||||||||
三 | ||||||||
(2)A、B、C、D、E、F六种元素中非金属性最强的是____________(填元素符号),B、D两元素可以组成原子个数比为1:1的离子化合物,写出该离子化合物的电子式:______,A、B两元素对应的气态氢化物的稳定性强弱关系是________________(用化学式表示)。
(3)写出D、F两元素的最高价氧化物对应的水化物反应的离子方程式:________________________