题目内容
【题目】研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)①已如:2SO2(g)+O2(g)2SO3(g) △H=-196.6kJmol-1
2NO(g)+O2(g)2NO2(g) △H=-113.0kJmol-1
请写出NO2与SO2反应生成SO3(g)和NO的热化学力程 式_________________________。
②一定条件下,将NO2与SO2以体积比1:2置于2L密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。(填字母序号)
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO2的同时生成1mlINO2
(2)①工 业上一般以CO和H2为原料合成甲醇。该反应的热化学方程式为:CO(g)+2H2(B)![]() CH3OH(g)△H=-99kJmol-1。则反应物的总能量__________(填高于、低于或者等于)生成物的总能量。
CH3OH(g)△H=-99kJmol-1。则反应物的总能量__________(填高于、低于或者等于)生成物的总能量。
②在恒温条件下体积为2L的密闭容器中,将1mol CO与3molH2的混合气体在催化剂作用下发生反应生成甲醇。2min时制得生成CH3OH0.2mol,则0~2min的平均反应速率v(H2)=_________。CO 的转化率为_______。反应前后的压强比为____________。
③恒温恒容时,改变下列条件能加快以上反应的速率的是__________(填字母序号)。
a.充入情性气体 b.增加CO的量 C.升高温度 d.减小H2的量
【答案】 NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=-41.8kJ/mol bd 高于 0.l mol·L-1·min-1 20% 10:9 bc
SO3(g)+NO(g) △H=-41.8kJ/mol bd 高于 0.l mol·L-1·min-1 20% 10:9 bc
【解析】试题分析:(1) ①根据盖斯定律写NO2与SO2反应生成SO3(g)和NO的热化学力程式;②根据化学平衡的特征分析平衡状态;(2)①根据热化学方程式,焓变小于0,反应放热;②根据![]() 计算反应速率;转化率=变化量÷初始量;同温同体积,压强比等于物质的量比;③根据影响反应速率的因素分析;
计算反应速率;转化率=变化量÷初始量;同温同体积,压强比等于物质的量比;③根据影响反应速率的因素分析;
解析:(1) ①2SO2(g)+O2(g)2SO3(g) △H=-196.6kJmol-1;②2NO(g)+O2(g)2NO2(g) △H=-113.0kJmol-1,根据盖斯定律①×![]() -②×
-②×![]() 得NO2(g)+SO2(g)
得NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=-41.8kJ/mol;②a.该反应前后气体物质的量不变,压强是恒量,体系压强保持不变不一定平衡,故a错误;b.混合气体颜色保持不变,说明NO2浓度不变,一定平衡,故b正确;c.SO3和NO都是生成物,体积比一直保持1:1,故c错误; d.每消耗1molSO2的同时生成1mlINO2,说明正逆反应速率相等,一定达到平衡状态,故d正确。(2)①根据热化学方程式,焓变小于0,反应放热,应物的总能量高于生成物的总能量;②
SO3(g)+NO(g) △H=-41.8kJ/mol;②a.该反应前后气体物质的量不变,压强是恒量,体系压强保持不变不一定平衡,故a错误;b.混合气体颜色保持不变,说明NO2浓度不变,一定平衡,故b正确;c.SO3和NO都是生成物,体积比一直保持1:1,故c错误; d.每消耗1molSO2的同时生成1mlINO2,说明正逆反应速率相等,一定达到平衡状态,故d正确。(2)①根据热化学方程式,焓变小于0,反应放热,应物的总能量高于生成物的总能量;②
根据![]() ,v(H2)=
,v(H2)= ![]() 0.l mol·L-1·min-1 ;
0.l mol·L-1·min-1 ; ![]() 20%;同温同体积,压强比等于物质的量比,反应前后的压强比为(0.5+1.5):(0.4+1.3+0.1)=10:9;③a、恒温恒容时,充入情性气体,浓度不变,反应速率不变,故a错误; b.增加CO的量,反应物浓度增大,反应速率加快,故b正确;c.升高温度,反应速率加快,故c正确; d.减小H2的量,反应物浓度减小,反应速率减小,故d错误。
20%;同温同体积,压强比等于物质的量比,反应前后的压强比为(0.5+1.5):(0.4+1.3+0.1)=10:9;③a、恒温恒容时,充入情性气体,浓度不变,反应速率不变,故a错误; b.增加CO的量,反应物浓度增大,反应速率加快,故b正确;c.升高温度,反应速率加快,故c正确; d.减小H2的量,反应物浓度减小,反应速率减小,故d错误。

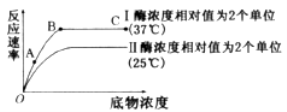
【题目】酶在酶促反应中能催化特定的底物(酶进行催化反应的反应物)反应,与酶的活性中心有关。酶的活性中心往往与底物分子在空间结构上具有特殊的匹配关系,当酶与底物结合时,启动化学反应的发生。请据图回答问题:

(1)上图所示过程能说明酶具有 的特点。
(2)酶能提高反应速率的机理是 ,使底物分子从常态转变为容易发生化学反应的活跃状态。
(3)下列符合图示反应类型的有 。
A.氨基酸a+氨基酸b→二肽+H2O
B.麦芽糖+H2O→葡萄糖
C.CO2+H2O→(CH2O)+O2
D.H2O2→H2O+O2
(4)请在下表中写出两个与酶有关的实验中的自变量:
序号 | 实验名称 | 自变量 | 因变量 |
① | 探索淀粉酶对淀粉和蔗糖水解的作用 | 加斐林试剂水浴加热,有无砖红色(沉淀)出现 | |
② | 研究温度对淀粉酶活性的影响 | 加碘后溶液颜色的变化 |