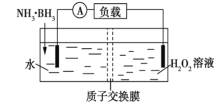
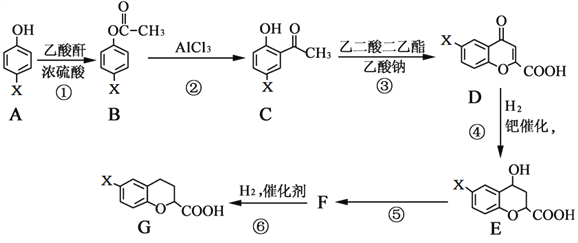
题目内容
【题目】氯酸钾和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。
(1) 请补充空白并配平化学方程式。
____KClO3+____HCl(浓) → ____KCl+____ClO2↑+____Cl2↑+ ___
(2) 浓盐酸在反应中显示出来的性质是________(填序号)
A. 只有还原性 B. 还原性和酸性 C.只有氧化性 D.氧化性和酸性
(3) 若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为________。
(4) ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的______倍。
(5)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式:___________________________________。
取2.76 g CaO2·8H2O样品受热脱水过程的热重曲线(140 ℃时完全脱水,杂质受热不分解)如图所示。
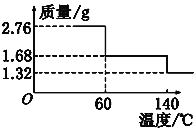
①试确定60 ℃时CaO2·xH2O中x=________。
②该样品中CaO2的质量分数为________。(保留一位小数)
【答案】2 4 2 2 1 2H2O B 0.4mol 2.5 CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl 2 26.09%
【解析】
(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,结合元素守恒,可知未知物是水,水的系数是2,其反应方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O;
(2)反应2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O中,HCl中氯元素化合价由1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各有一半,故选B;
(3)若反应中生成标准状况下13.44L气体,即生成13.44L÷22.4L/mol=0.6mol的气体,因为生成二氧化氯和氯气的物质的量之比为1:2,所以分别生成0.2mol二氧化氯和0.4mol氯气,则消耗还原剂的物质的量为0.4mol;
(4)1molH2O2可以得到2mol电子,1molClO2可以得到5mol电子,ClO2消毒的效率是过氧化氢的![]() ;
;
(5)通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,反应的化学方程式为CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl
①由图中可看出,140℃以后,结晶水全部脱去,脱去的水的质量为2.76g-1.32g=1.44g,故水的物质的量为0.08mol,CaO2·8H2O的物质的量为0.01mol,由曲线图可看出,60-140℃失去结晶水的质量为1.68g-1.32g=0.36g,物质的量为0.02mol,则x=2;
②过氧化钙的质量为0.01mol×72g·mol-1=0.72g,故该样品中过氧化钙的质量分数为![]() ×100%=26.09%。
×100%=26.09%。

 阅读快车系列答案
阅读快车系列答案