题目内容
【题目】甲烷既是重要的能源也是重要的化工原料。
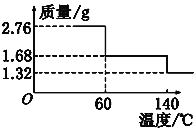
已知反应CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),起始时向体积为V的恒容密闭容器中通入2molCH4和3molNO2,测得CH4、N2、H2O的物质的量浓度与时间的关系如图所示。
N2(g)+CO2(g)+2H2O(g),起始时向体积为V的恒容密闭容器中通入2molCH4和3molNO2,测得CH4、N2、H2O的物质的量浓度与时间的关系如图所示。
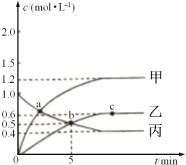
(1)容器体积V=_____L。
(2)图中表示H2O的物质的量浓度与时间关系的是曲线_____(填“甲”“乙"或"丙")。
(3)0~5min内,用N2表示的化学反应速率为_____mol·L-1·min-1。
(4)a、b、c三点中达到平衡的点是______。达到平衡时,NO2的转化率是_____。(物质平衡转化率=转化的物质的量/起始的物质的量×100%)。
(5)a点时,n(CH4):n(NO2)=_____。
【答案】2 甲 0.1 c 80%或0.8 4:5
【解析】
(1)有甲烷的物质的量和浓度可以求得容器的体积;
(2)N2、H2O的化学计量数之比是1:2,可以推出水的物质的量浓度与时间关系的曲线;
(3)化学反应速率等于浓度的变化量除以时间;
(4)可逆反应达到平衡时反应物和生成物的浓度不变,物质平衡转化率=转化的物质的量/起始的物质的量×100%;
(5)a点时,甲曲线和丙曲线的浓度相等,即是物质的量相等,利用方程式进行计算。
(1)向体积为V的恒容密闭容器中通入2molCH4,从图中知道甲烷的起始物质的量浓度是1.0mol/L,得出容器体积V=2L,故答案为:2;
(2)甲,乙曲线是生成物的浓度变化量,氮气和水的化学计量数之比是1:2,可以推出甲曲线是H2O的物质的量浓度与时间关系的曲线,故答案为:甲;
(3)N2的化学反应速率为![]() =
=![]() 0.1 mol·L-1·min-1,故答案为:0.1;
0.1 mol·L-1·min-1,故答案为:0.1;
(4)可逆反应达到平衡时各物质的浓度保持不变,c点时乙曲线的浓度保持不变,是平衡点,达到平衡时,生成氮气的物质的量浓度是0.6mol/L,容积的体积是2L,即是氮气的物质的量是1.2mol,消耗二氧化氮2.4mol,NO2的转化率是![]() ×100%= 80%,故答案为:c;80%或0.8;
×100%= 80%,故答案为:c;80%或0.8;
(5)a点时,设水的物质的量是2xmol,有方程式可知消耗甲烷的物质的量xmol,剩余甲烷的物质的量是(2-x)mol,由于甲烷的浓度等于水的浓度,可知甲烷的物质的量等于水的物质的量,即2x=2-x,解得x=2/3mol,消耗二氧化氮的物质的量是4/3mol,剩余甲烷的物质的量是2-x=2-2/3mol=4/3mol,剩余二氧化氮的物质的量是3-2x=3-4/3mol=5/3mol,n(CH4):n(NO2)=4/3mol:5/3mol=4:5,故答案为:4:5。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】下面列出了几组物质,请用物质的组号填写下表。
类型 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
组号 | _____ | _____ | _____ | _____ |
①CH(CH3)3和CH3CH2CH(CH3)2
②C(CH3)4和CH3CH2CH(CH3)2
③CH4和CH3CH2CH3
④金刚石和石墨
⑤H、D、T
⑥12C、13C、14C
⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3)
⑧臭氧(18O3)和氧气(16O18O )
⑨ 和
和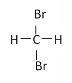
⑩ H216O和H218O