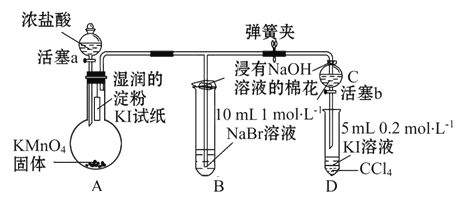
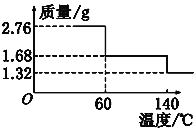
题目内容
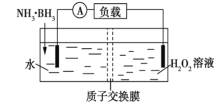
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2═NH4BO2+4H2O。已知两极室中电解质足量,下列说法错误的是( )
A. 正极的电极反应式为3H2O2+6H++6![]() ═6H2O
═6H2O
B. 电池工作时,H+通过质子交换膜从右向左移动
C. 电池工作时,两电极均不会产生气体
D. 工作一段时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol电子。
【答案】B
【解析】
根据电池反应NH3·BH3+3H2O2═NH4BO2+4H2O,NH3·BH3反应后B元素化合价升高,被氧化,则通入NH3·BH3的电极为负极,结合原电池原理分析解答。
A.根据上述分析,右侧H2O2为正极,H2O2得到电子,发生还原反应,电极反应式为3H2O2+6H++6e-═6H2O,故A正确;
B.电池工作时,阳离子移向正极,因此H+通过质子交换膜从左向右移动,故B错误;
C.根据电池反应NH3·BH3+3H2O2═NH4BO2+4H2O,电池工作时,两电极均不会产生气体,故C正确;
D.该电池工作时,负极的反应式为NH3·BH3-6e-+2H2O═NH4BO2+6H+,正极的反应式为3H2O2+6H++6e-═6H2O,通入1mol NH3·BH3工作后,左极室质量增加17+14-6=25g,右极室质量增加6g,左右两极室质量差25-6=19g,若左右两极室质量差为1.9 g,则电路中转移的电子的物质的量=![]() ×6=0.6 mol,故D正确;
×6=0.6 mol,故D正确;
答案选B。

练习册系列答案
相关题目