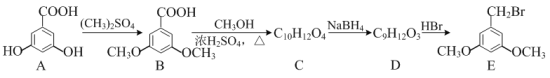题目内容
【题目】下列有关一定物质的量浓度的溶液配制的过程中,造成所得的溶液浓度偏大的是
A.要配制100 mL 1 mol·L-1 NaOH溶液,在白纸上称4 g NaOH固体,并且称量速度较慢
B.定容时俯视容量瓶刻度线
C.溶解或稀释溶质时烧杯尚未干燥
D.定容时盖上瓶盖,摇匀后发现液面低于刻度线,再继续滴加蒸馏水使液面重新达到刻度线
【答案】B
【解析】
A.白纸上称4g NaOH固体,并且称量速度较慢,会导致NaOH固体潮解,NaOH固体的实际质量偏小,而且NaOH会因为潮解沾在纸上,使溶质的质量进一步减少,则所配制溶液浓度偏低,A不符合题意;
B.定容时俯视容量瓶刻度线,则溶液的体积偏小,根据物质的量浓度定义式c=![]() ,可知溶液的浓度偏高,B符合题意;
,可知溶液的浓度偏高,B符合题意;
C.溶解或稀释溶质时烧杯尚未干燥,由于不影响溶质的质量和溶液的体积,则根据物质的量浓度定义式c=![]() ,可知该操作对溶液的浓度无影响,C不符合题意;
,可知该操作对溶液的浓度无影响,C不符合题意;
D.定容时盖上瓶盖,摇匀后,由于少量液体沾在容量瓶的瓶颈上,使液面低于刻度线,由于溶液是均一的、稳定的,所以溶液浓度不变;若再继续滴加蒸馏水使液面重新达到刻度线,则会对溶液起稀释作用,使所配溶液浓度偏低,D不符合题意。
故合理选项是B。

练习册系列答案
相关题目