题目内容
【题目】下列变化为放热反应的是( )
A.H2O(g)=H2O(l) △H=-44.0 kJ/mol
B.2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应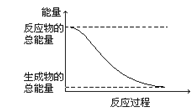
【答案】D
【解析】
A. H2O(g)=H2O(l) 不是化学反应,所以不是放热反应,故不选A;
B. 2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol,焓变大于0,为吸热反应,故不选B;
C. 形成化学键时共放出能量862 kJ,但不知断键时吸收的热量多少,二者的差值无法计算,所以不能判断反应是否是放热反应,故不选C;
D. 根据图示,反应物的总能量大于生成物总能量,一定为放热反应,故选D;
答案选D。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s) + CO(g)
Fe2O3(s) + CO(g) ![]()
![]() Fe(s) + CO2(g)。已知该反应在不同温度下的平衡常数如下:
Fe(s) + CO2(g)。已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”)。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=______________________、CO的平衡转化率= _____________。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)在1L的密闭容器中,1300℃条件,下列达平衡状态的是_______________。
A | B | C | D | |
n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
n(CO2) | 0.035 | 0.088 | 0.040 | 0.050 |
.
【题目】X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大,有关信息如下表:
X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
Y | 地壳中含量位居第一位 |
Z | 短周期中,其原子半径最大 |
Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
请用对应元素的化学符号或化学式回答下列问题:
(1)X在周期表中的位置为_________;X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题.请写出该气态氢化物的电子式_________。
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法中正确的是________(填序号)。
a.原子半径:Rb>I
b.RbM中含有共价键
c.气态氢化物热稳定性:M>I
d.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料,其抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料。可用Q的氧化物、焦炭和X的单质在高温下生成QX,已知每生成1mol QX,消耗18g碳,吸收a kJ的热量。据此,写出以上制取QX的热化学方程式__________。
(4)X、Y组成的一种无色气体遇空气变为红棕色,将一定量该无色气体与氧气通入水中,恰好被完全吸收,生成一种酸,请写出该反应的化学方程式_______________。