题目内容
【题目】下表1是常温下几种弱酸的电离平衡上述(Ka)和弱碱的电离平衡常数(Kb),表2时常温下几种难(微)溶物的溶度积常数(Kap)
表1 | |
酸或碱 | 电离常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HIO3 | 1.7×10-1 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3H2O | 1.8×10-5 |
表2 | |
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
请回答下面问题:
(1)上述四种酸中,酸性最强的是______________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是______(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)HCOONH4的水溶液呈_______(选填“酸性”、“中性”、“碱性”),写出HCOONH4水解的离子反应方程式____________。
(3)物质的量1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为___。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,最终 SO42-物质的量浓度达到0.05mol·L-1,则此时溶液中CO32-物质的量浓度应_____________mol·L-1。
【答案】 HIO3 B 酸性 HCOO-+NH4++H2O=HCOOH+NH3·H2O c(Na+)>c(CN-)>c(OH-)>c(H+) 1.3
【解析】(1)电离平衡常数越大,酸性越强,则上述四种酸中,酸性最强的是HIO3。A.升高温度常见电离,电离常数增大,A错误;B.加水稀释常见电离,温度不变,电离平衡常数不变,B正确;C.加少量的CH3COONa固体抑制醋酸电离,C错误;D.加少量冰醋酸电离程度减小,D错误,答案选B。(2)甲酸的电离常数大于一水合氨的,因此HCOONH4的水溶液中铵根的水解程度大于甲酸跟,因此溶液呈酸性,HOONH4水解的离子反应方程式为 HCOO-+NH4++H2O![]() HCOOH+NH3·H2O;(3)物质的量1:1的NaCN和HCN的混合溶液,其pH>7,说明电离程度小于水解程度,因此该溶液中离子的浓度从大到小排列为c(Na+)>c(CN-)>c(OH-)>c(H+)。(4)最终SO42-物质的量浓度达到0.05mol·L-1,则此时溶液中钡离子浓度是1×10-10/0.05mol·L-1=2×10-9mol/L,所以CO32-物质的量浓度=2.6×10-9/2×10-9mol/L=1.3mol·L-1。
HCOOH+NH3·H2O;(3)物质的量1:1的NaCN和HCN的混合溶液,其pH>7,说明电离程度小于水解程度,因此该溶液中离子的浓度从大到小排列为c(Na+)>c(CN-)>c(OH-)>c(H+)。(4)最终SO42-物质的量浓度达到0.05mol·L-1,则此时溶液中钡离子浓度是1×10-10/0.05mol·L-1=2×10-9mol/L,所以CO32-物质的量浓度=2.6×10-9/2×10-9mol/L=1.3mol·L-1。

【题目】资料显示“O2的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应.实验如下。
装置 | 烧杯中的液体 | 现象(5分钟后) |
| ①2 mL1 mol/LKI溶液+5滴淀粉 | 无明显变化 |
②2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L HCl | 溶液变蓝 | |
③2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L KCl | 无明显变化 | |
④2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
(1)实验②中生成I2的离子方程式是___________。
(2)实验③的目的是_________________________________________________________________。
(3)实验④比②溶液颜色浅的原因是________。
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
烧杯中的液体 | 现象(5小时后) |
⑤2 mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
⑥2 mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
I.对于实验⑥的现象.甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验,验证猜想。
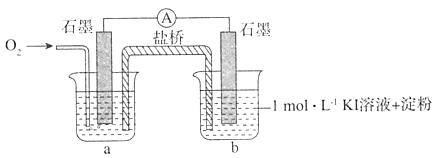
i.烧杯a中的溶液为____。
ii.实验结果表明,此猜想不成立。支持该结论的实验现象是:通入O2后,_______。
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)____________。
(5)该小组同学对实验过程进行了整体反思.推测实验①的现象产生的原因可能是______;实验⑥的现象产生的原因可能是_______。