题目内容
【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(Ⅵ)是主要污染物,可采用多种处理方法将其除去。查阅资料可知:
①在酸性环境下,Cr(Ⅵ)通常以Cr2O72-的形式存在;
②Cr2O72-的氧化能力强于CrO42-;
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的pH | 1.9 | 7.0 | 4.3 |
沉淀完全的pH | 3.2 | 9.0 | 5.6 |
Ⅰ.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(Ⅵ)。下列关于焦炭的说法正确的是_______(填字母代号)。
a.作原电池的正极 b.在反应中作还原剂 c.表面可能有气泡产生
Ⅱ.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。电解装置如图1所示。
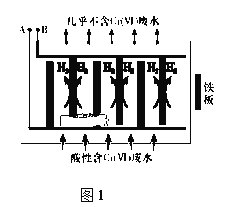
(2)A极连接电源的______________极,A极上发生的电极反应式为_______________
(3)电解开始时,B极上除了发生产生H2的反应外,还有少量Cr2O72-在B极上直接放电,该反应的电极反应式为_________________
(4)电解过程中,溶液的pH不同时,通电时间(t)与溶液中铬元素去除率的关系如图2所示。
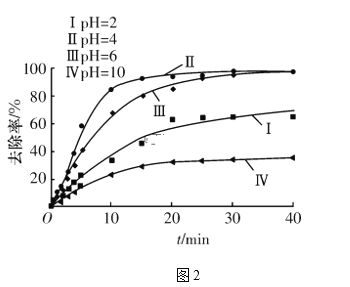
①由图可知,电解还原法应采取的最佳pH范围为____(填字母代号)。
a.2~4 b.4~6 c.6~10
②解释曲线Ⅰ和曲线Ⅳ去除率低的原因:________________
【答案】ac 正 Fe-2e-===Fe2+ Cr2O72-+14H++6e-===2Cr3++7H2O b 曲线Ⅰ的pH较小,此时Cr(Ⅵ)被还原生成的Cr3+难以生成Cr(OH)3沉淀,仍以Cr3+形式存在于溶液中,导致去除率较低;曲线Ⅳ的pH较大,铬元素主要以CrO42-形式存在,其氧化能力弱于Cr2O72-,Cr(Ⅵ)难以被还原并生成沉淀,导致去除率较低
【解析】
根据题意可知,本题考查电解原理及其应用、“三废”处理与环境保护,运用电化学原理和除杂原理分析。
(1)向酸性含铬废水中投放废铁屑和焦炭,形成原电池,铁作原电池的负极,发生氧化反应,电极反应式为Fe-2e-===Fe2+;焦炭作正极,但焦炭是惰性材料,本身不能被还原,由于废水呈酸性,正极上可能发生反应2H++2e-===H2↑,观察到焦炭表面有气泡产生,则a、c正确,
故答案为:ac;
(2)由图可知,与电源的B极相连的一极表面产生H2,该电极的电极反应为2H++2e-===H2↑,则B是电源负极,A是电源正极;与A极相连的电极为电解池的阳极,电极材料是Fe,Fe发生氧化反应,电极反应式为Fe-2e-===Fe2+。
故答案为:Fe-2e-===Fe2+;
(3)B极是阴极,发生还原反应,少量Cr2O![]() 在B极上直接放电被还原为Cr3+,电解质溶液呈酸性,则电极反应式为Cr2O
在B极上直接放电被还原为Cr3+,电解质溶液呈酸性,则电极反应式为Cr2O![]() +14H++6e-===2Cr3++7H2O。
+14H++6e-===2Cr3++7H2O。
故答案为:Cr2O![]() +14H++6e-===2Cr3++7H2O;
+14H++6e-===2Cr3++7H2O;
(4)①由图可知,曲线Ⅱ对应pH=4时,溶液中铬元素去除率最大,且所用时间最短,反应速率快;曲线Ⅲ对应pH=6时,铬元素去除率最终与pH=4相同,但所用时间较长,反应速率比pH=4慢;图中曲线Ⅰ、Ⅳ 对应的铬元素去除率偏低,故最佳pH范围为4~6,答案选b。
故答案选:b;
②由题给信息可知,去除废水中的铬元素,最终要生成Cr(OH)3和Fe(OH)3沉淀排出。曲线Ⅰ的pH=2,酸性较强,此时Cr(Ⅵ)被还原生成的Cr3+难以生成Cr(OH)3沉淀,仍以Cr3+形式存在于溶液中,导致铬元素去除率较低;曲线Ⅳ的pH=10,溶液呈碱性,促使平衡Cr2O3-+H2O![]() 2CrO
2CrO![]() +2H+正向移动,铬元素主要以CrO
+2H+正向移动,铬元素主要以CrO![]() 形式存在,其氧化能力弱于Cr2O
形式存在,其氧化能力弱于Cr2O![]() ,Cr(Ⅵ)难以被还原并生成沉淀,导致铬元素去除率较低。
,Cr(Ⅵ)难以被还原并生成沉淀,导致铬元素去除率较低。
故答案为:曲线Ⅰ的pH较小,此时Cr(Ⅵ)被还原生成的Cr3+难以生成Cr(OH)3沉淀,仍以Cr3+形式存在于溶液中,导致去除率较低;曲线Ⅳ的pH较大,铬元素主要以CrO42-形式存在,其氧化能力弱于Cr2O72-,Cr(Ⅵ)难以被还原并生成沉淀,导致去除率较低。

【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
(2)从下表中选择,称量NaOH固体所需要的仪器是(填字母)________。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示。
(1)若生成1 mol H2O时反应放出的热量为57.3 kJ,写出该反应的热化学方程式:__________。
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②用上述实验数值计算结果为____kJmol-1,与57.3 kJmol-1有偏差,产生偏差的原因可能是_____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【题目】氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
时间(s) | 0 | 2 | 4 |
c(NO) ( mol·L-1) | 1.00×10-3 | 2.50×10-4 | 1.00×10-4 |
c(CO) ( mol·L-1) | 3.60×10-3 | c’ | 2.70×10-3 |
回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前4s内的平均反应速率v(NO)= 。c’= 。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图表示在其他条件不变时,上述反应中二氧化碳浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
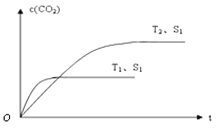
①该反应的ΔH 0(填“>”、“<”或“=”)。
②若催化剂的表面积S1>S2,在答题卡图中画出c(CO2) 在T2、S2条件下达到平衡过程中的变化曲线。
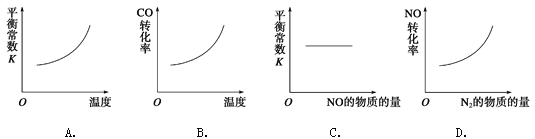
(3)在恒容的密闭容器中,上述反应达到平衡后,改变某一条件,下列示意图正确的是