题目内容
【题目】最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。
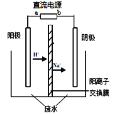
(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入 (填化学式)气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应如下:
阳极:① 4OH--4e-=O2↑+2H2O② 。
阴极:① 。②CH3CHO+2e-+2H2O=CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量 (填“增大”、“减小”或“不变”)。
(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填字母序号)。
a.c(Na+)不一定是c(SO42-)的2倍
b.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c.c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
d.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)高纯度氧化铝是用于制备隔膜的材料,某研究小组用以下流程制取高纯度氧化铝:

①“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
②配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
③“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
【答案】(1)CH4 (2)CH3CHO-2e-+H2O=CH3COOH+2H+
2H++2e-=H2↑或4H2O+4e-=2 H2↑+4OH-
(3)不变 (4)abd (5)①2Fe2++H2O2+4NH3H2O=2Fe(OH)3↓+4NH4+
②抑制(防止)Al3+水解 ③减少可溶性杂质的析出及Al3+水解
【解析】
试题分析:(1)b为原电池的负极,发生氧化反应,应通入CH4;
(2)阳极发生氧化反应,生成乙酸和氧气,电极反应为CH3CHO-2e-+H2O═CH3COOH+2H+,阴极发生还原反应,生成乙醇和氢气,电极反应为4H++4e-═2H2↑或4H2O+4e-═2H2↑+4OH-;
(3)硫酸钠不参与电解反应,物质的量不变;
(4)a.钠离子经过阳离子离子交换膜进入阴极,而硫酸根离子不能经过阳离子交换膜,则c(Na+)不一定是c(SO42-)的2倍,故a正确;b.Na2SO4与CH3COOH的物质的量相同,则有c(Na+)=2c(CH3COOH)+2c(CH3COO-),故b正确;c.电荷不守恒,应为c(Na+)+c(H+)=2c(SO42-)+c(CH3COO-)+c(OH-),故c错误;d.醋酸为弱电解质,主要以分子形成存在,则有c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-),故d正确;故答案为abd;
(5)①亚铁离子具有还原性,双氧水具有强氧化性,在碱性溶液中,亚铁离子被氧化生成铁离子,铁离子与氢氧根结合生成氢氧化铁沉淀,此反应的离子反应方程式为:2Fe2++H2O2+4NH3H2O=2Fe(OH)3↓+4NH4+;
②由于铝离子在溶液中能够发生水解生成氢氧化铝,所以加入硫酸酸化,抑制了铝离子的水解;
③由于蒸干会析出可溶性杂质的析出,且Al3+水解程度增大,所以母液不能蒸干。

【题目】近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。回答下列问题:
(l)汽车发动机工作时会引起反应:N2(g)+O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。2000K时,向容积为2L的密闭容器中充入2molN2与2molO2,发生上述反应,经过5min达到平衡,此时容器内NO的体积分数为0.75% .则该反应在5min内的平均反应速率v(O2)=_______mol/(Lmin),N2的平衡转化率为_______,2000K时该反应的平衡常数K=_____。
2NO(g),是导致汽车尾气中含有NO的原因之一。2000K时,向容积为2L的密闭容器中充入2molN2与2molO2,发生上述反应,经过5min达到平衡,此时容器内NO的体积分数为0.75% .则该反应在5min内的平均反应速率v(O2)=_______mol/(Lmin),N2的平衡转化率为_______,2000K时该反应的平衡常数K=_____。
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如右图所示。
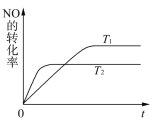
① 反应2NO(g)![]() N2(g)+O2(g)为______反应(填“吸热”或“放热”) ;
N2(g)+O2(g)为______反应(填“吸热”或“放热”) ;
②一定温度下,能够说明反应2NO(g)![]() N2(g)+O2(g)已达到平衡的是_____(填序号);
N2(g)+O2(g)已达到平衡的是_____(填序号);
a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c. 2NO、N2、O2的浓度保持不变
d.单位时间内分解4molNO,同时生成2molN2
③ 在四个容积和温度均完全相同的密闭容器中分别加入下列物质,相应物质的量(mol)如下表所示。相同条件下达到平衡后,N2的体积分数最大的是_______(填容器代号);
容器代号 | NO | N2 | O2 |
A | 2 | 0 | 0 |
B | 0 | l | l |
C | 0.4 | 0.6 | 0.8 |
D | l | 0.5 | 0.4 |
(3)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx。可用CH4催化还原NOx以消除氮氧化物污染。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ·mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:___________;
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为___________________。
