题目内容
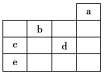
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质既可以与盐酸反应,又可以与NaOH溶液反应放出H2,且E的阳离子与A的阴离子核外电子层结构完全相同。

回答下列问题:
(1)A与E形成的化合物的化学式是 __________________。
(2)B的最高价氧化物化学式为_____________,C的元素名称为 __________,D的单质与水反应的方程式为___________________。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是________________________,有关反应的离子方程式为________________________。
【答案】 Al2O3 P2O5 硫 Cl2+H2O=HCl+HClO 先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O
【解析】根据A、B、C、D四种短周期元素在图中位置可知,A为第二周期元素,B、C、D为第三周期元素,设C的核外电子数为X,则A、B、D的最外层电子数为分别为X-8,X-1,X+1,所以:X+X-8+X-1+X+1=56,解得X=16,则B为磷,C为硫,D为氯,A为氧;根据E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2,可知E为+3价金属,又E的阳离子与A的阴离子核外电子层结构相同,则E为铝.
(1)根据由金属元素和非金属元素形成的化学键一般为离子键;
(2)根据由非金属元素和非金属元素形成的化学键一般为共价键;
(3)根据氢氧化铝为两性氧化物既可与酸反应,也可与碱反应;
解析:根据以上分析,(1)因A为氧,E为铝,A与E形成的化合物的化学式是Al2O3;
(2)因B为磷元素,所以B的最高价氧化物化学式为P2O5;C为硫元素;D为氯,其单质氯气与水反应生成盐酸和次氯酸:Cl2+H2O![]() H++Cl-+HClO;
H++Cl-+HClO;
(3)氢氧化铝为难溶于水的两性氢氧化物能与碱反应生成盐和水,所以向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是先有白色胶状氢氧化铝沉淀产生并逐渐增多,随NaOH加入氢氧化铝又逐渐溶解,最终澄清,离子方程式为:Al3++3OH-=Al(OH)3↓ (7). Al(OH)3+OH-=AlO2-+2H2O。
点睛;氢氧化铝为难溶于水的两性氢氧化物能与碱反应生成盐和水,又能与酸反应生成盐和水。

【题目】镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成。放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究。
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
M(OH)n | Ksp | pH | |
开始沉淀 | 沉淀完全 | ||
Al(OH)3 | 2.0×10-32 | 3.8 | —— |
Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
回答下列问题:
(1)该电池的负极材料是___________________,正极反应式为_________________,
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作__________min(小数点后保留2位)。(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是_____________。过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是_______________和___________________。若将两种杂质阳离子都沉淀析出,pH应控制在___________(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案_____________。
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4·2H2O和滤液A,A的主要成分是_____________;电解滤液A,在阴极产生气体B______(填分子式);在阳极产生气体C______(填分子式)。将NiC2O4·2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为______(填“B”、“C”)极气体,判断依据是_________。