题目内容
铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:(1)Tl3++2Ag=Tl++2Ag+,(2)Ag++Fe2+=Ag+Fe3+,(3)Fe+2Fe3+=3Fe2+,下列离子氧化性比较顺序正确的是 ( )。
| A.Tl3+>Fe3+>Ag+ | B.Fe3+>Ag+>Tl3+ |
| C.Tl+>Ag+>Fe2+ | D.Tl3+>Ag+>Fe3+ |
D
解析

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案某金属单质能与足量浓硝酸反应,放出NO2气体,若参加反应的金属单质与硝酸的物质的量之比为1:a,则该金属元素在反应后生成的硝酸盐中的化合价是
| A.+2a | B.+a | C.+a/2 | D.+a/4 |
一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3的物质的量之比为3:5,则参加反应的Cl2与NaOH的物质的量之比为( )
| A.8:11 | B.3:5 | C.1:2 | D.9:4 |
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到达平衡状态 |
| B.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5 |
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
| A.与NaOH反应的氯气一定为0.3 mol |
| B.n(Na+):n(Cl-)可能为7:3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
有Fe2+、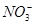 、Fe3+、
、Fe3+、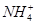 、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
| A.氧化剂和还原剂的物质的量之比为1∶8 |
| B.该反应说明Fe(NO3)2溶液不宜加酸酸化 |
C.每1 mol 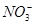 发生氧化反应,转移8 mol e- 发生氧化反应,转移8 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50 ℃时反应可生成CuH。下列叙述中错误的是 ( )。
| A.“某物质”具有还原性 |
| B.CuH与盐酸反应可能产生H2 |
| C.CuH与足量稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O |
| D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl |
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+―→Cr3++Fe3++H2O ②。下列有关说法正确的是 ( )。
| A.还原性:Cr3+>SO2 |
| B.方程式②中,a=6,b=7 |
| C.Cr2O72-能将Na2SO3氧化成Na2SO4 |
| D.方程式①中W为OH- |
取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL N2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于( )
| A.8.64 g | B.9.20 g |
| C.9.00 g | D.9.44 g |