题目内容
【题目】Mg和Mg2+两种微粒中,具有相同的
A.核内质子数B.核外电子数C.最外层电子数D.核外电子层数
【答案】A
【解析】
A. 核内质子数相同,都是12,A项正确;
B. 核外电子数不同,分别是12和10,B项错误;
C. 最外层电子数不同,分别是2和8,C项错误;
D. 核外电子层数不同,分别是3和2,D项错误;
答案选A。

【题目】根据高中所学的化学反应原理解答下面的问题:
(1)下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0 kJmol﹣1
反应Ⅱ:2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)△H=﹣173.6kJmol﹣1
写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:
(2)工业合成甲醇的反应:CO(g)+2H2(g)CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
温度/℃ | 250 | 350 |
K | 2.041 | x |
符合表中的平衡常数x的数值是(填字母序号).
A.0 B.0.012
C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
c(CO) | c(H2) | c(CH3OH) | |
0min | 0.8molL﹣1 | 1.6molL﹣1 | 0 |
2min | 0.6molL﹣1 | y | 0.2molL﹣1 |
4min | 0.3molL﹣1 | 0.6molL﹣1 | 0.5molL﹣1 |
6min | 0.3molL﹣1 | 0.6molL﹣1 | 0.5molL﹣1 |
反应从2min到4min之间,H2的平均反应速率为 . 反应达到平衡时CO的转化率为 . 反应在第2min时改变了反应条件,改变的条件可能是(填字母序号).
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.升高温度
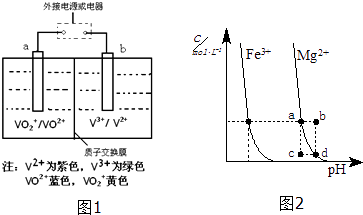
(3)全钒液流储能电池(VRB)广泛应用于风能、太阳能发电系统的储能系统,电池反应为VO2++V2++2H+ ![]() VO2++V3++H2O,试推写出放电时正极的电极反应式 .
VO2++V3++H2O,试推写出放电时正极的电极反应式 .
(4)如图2为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:该温度下,溶度积常数的关系为:Ksp[Fe(OH)3] Ksp[Mg(OH)2](填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+ , 振荡后,白色沉淀会全部转化为红褐色沉淀,原因是 .