题目内容
【题目】根据高中所学的化学反应原理解答下面的问题:
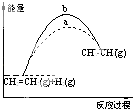
(1)下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0 kJmol﹣1
反应Ⅱ:2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)△H=﹣173.6kJmol﹣1
写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:
(2)工业合成甲醇的反应:CO(g)+2H2(g)CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
温度/℃ | 250 | 350 |
K | 2.041 | x |
符合表中的平衡常数x的数值是(填字母序号).
A.0 B.0.012
C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
c(CO) | c(H2) | c(CH3OH) | |
0min | 0.8molL﹣1 | 1.6molL﹣1 | 0 |
2min | 0.6molL﹣1 | y | 0.2molL﹣1 |
4min | 0.3molL﹣1 | 0.6molL﹣1 | 0.5molL﹣1 |
6min | 0.3molL﹣1 | 0.6molL﹣1 | 0.5molL﹣1 |
反应从2min到4min之间,H2的平均反应速率为 . 反应达到平衡时CO的转化率为 . 反应在第2min时改变了反应条件,改变的条件可能是(填字母序号).
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.升高温度
(3)全钒液流储能电池(VRB)广泛应用于风能、太阳能发电系统的储能系统,电池反应为VO2++V2++2H+ ![]() VO2++V3++H2O,试推写出放电时正极的电极反应式 .
VO2++V3++H2O,试推写出放电时正极的电极反应式 .
(4)如图2为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:该温度下,溶度积常数的关系为:Ksp[Fe(OH)3] Ksp[Mg(OH)2](填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+ , 振荡后,白色沉淀会全部转化为红褐色沉淀,原因是 . 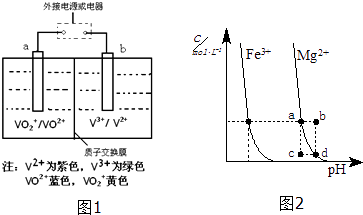
【答案】
(1)2CH3OH(g)?CH3CH2OH(g)+H2O(g)△H=﹣75.6 kJ?mol﹣1
(2)B;0.3 mol?L﹣1?min﹣1;62.5%;AD
(3)VO2++2H++e﹣=VO2++H2O
(4)<;浊液中存在溶解平衡:Mg(OH)2 ![]() Mg2++2OH﹣ , 当加入Fe3+后与OH﹣生成更难溶解的Fe(OH)3 , 使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3
Mg2++2OH﹣ , 当加入Fe3+后与OH﹣生成更难溶解的Fe(OH)3 , 使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3
【解析】解:(1)反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1
反应Ⅱ:2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)△H=﹣173.6kJmol﹣1
根据盖斯定律,Ⅱ﹣Ⅰ×2可得:2CH3OH(g)CH3CH2OH(g)+H2O(g)△H=﹣75.6kJmol﹣1 ,
所以答案是:2CH3OH(g)CH3CH2OH(g)+H2O(g)△H=﹣75.6kJmol﹣1;(2)①△H<0,所以正反应为放热反应,故平衡常数随着温度的升高而降低,x<2.041,而且因为是可逆反应,平衡常数不可能为0,
故选:B;
②根据表格中CO的浓度变化量可知△c(H2)=2×(0.6﹣0.3)mol/L=0.6mol/L,则v(H2)= ![]() =0.3 molL﹣1min﹣1;
=0.3 molL﹣1min﹣1;
4 min时,反应达到平衡,故CO的转化率= ![]() ×100%=62.5%;
×100%=62.5%;
4min内CO与氢气浓度变化量为0.5mol/L:1mol/L=1:2,等于化学计量数之比,不能是增大氢气浓度,而0~2 min的反应速率比2~4 min的反应速率小,故2 min时可能使用了催化剂或者升高温度;
所以答案是:0.3 molL﹣1min﹣1;62.5%;AD;(3)电池反应为VO2++V2++2H+ ![]() VO2++V3++H2O,放电时为原电池,正极发生还原反应,VO2+获得电子酸性条件下生成VO2+与H2O,电极反应式为VO2++2H++e﹣=VO2++H2O:,
VO2++V3++H2O,放电时为原电池,正极发生还原反应,VO2+获得电子酸性条件下生成VO2+与H2O,电极反应式为VO2++2H++e﹣=VO2++H2O:,
所以答案是:VO2++2H++e﹣=VO2++H2O;(4)由图可知,铁离子、镁离子浓度相同时,再沉淀溶解平衡溶液中氢氧化铁平衡体系中pH更小,即氢氧根离子浓度更小,故Ksp[Fe(OH)3]<Ksp[Mg(OH)2],浊液中存在溶解平衡:Mg(OH)2 ![]() Mg2++2OH﹣ , 当加入Fe3+后与OH﹣生成更难溶解的Fe(OH)3 , 使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3 ,
Mg2++2OH﹣ , 当加入Fe3+后与OH﹣生成更难溶解的Fe(OH)3 , 使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3 ,
所以答案是:<;浊液中存在溶解平衡:Mg(OH)2 ![]() Mg2++2OH﹣ , 当加入Fe3+后与OH﹣生成更难溶解的Fe(OH)3 , 使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3 .
Mg2++2OH﹣ , 当加入Fe3+后与OH﹣生成更难溶解的Fe(OH)3 , 使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3 .
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案【题目】研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答: 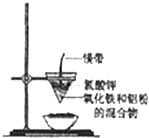
(1)氧化铁与铝反应的化学方程式是 ,
(2)镁带的作用是;氯酸钾的作用是 .
(3)同学们在实验过程中观察到纸漏斗的下部被烧穿,有熔融物落入沙中.他们为探究此熔融物的成分,查阅(化学手册)得知有关物质的熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | ﹣ |
同学们分析数据后推测该熔融物是一种合金,其中的金属是 , 溶解该合金可选用下列试剂中的(填序号).
A.FeSO4溶液 B.稀硫酸 C.稀硝酸 D.NaOH溶液.