题目内容
【题目】元素周期表的形式多种名样,如图是扇形元素周期表的一部分,下列说法正确的是
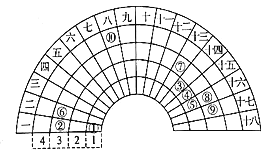
A. 简单氢化物的沸点: ④>⑤>⑨
B. 该表中标注的元素⑩处于第四周期ⅦB族
C. 元素⑥和⑦的原子序数相差11
D. 同温同压下,等质量的由元素⑤形成的两种气体单质含有相同的原子数
【答案】D
【解析】由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,则A. 水分子、氨气分子间存在氢键,则简单氢化物的沸点:⑤>④>⑨,A错误;B. 该表中标注的元素⑩是铁,处于第四周期Ⅷ族,B错误;C. 元素⑥和⑦的原子序数相差1,C错误;D. 同温同压下,等质量的由元素⑤形成的两种气体单质氧气和臭氧含有相同的原子数,D正确,答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)C8H8(g)+H2(g)△H>0 Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是 .
(2)该温度下,该反应的化学平衡常数是 .
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol1 | 412.5 | 348 | 612 | 436 |
(3)已知: 计算上述反应的△H=kJmol﹣1 . 若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是 . 此时,该反应是否达到了平衡状态?(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.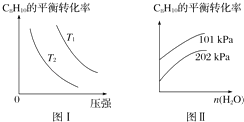
(4)由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是 .

