题目内容
17.将一小块钠投入到CuCl2溶液中,观察到的现象是( )| A. | 钠溶解,有铜析出并有气体产生 | B. | 只有气体产生 | ||
| C. | 只有沉淀产生 | D. | 既有气体产生,又有蓝色沉淀产生 |
分析 钠投入到盛有氯化铜溶液的烧杯里,发生反应有:2Na+2H2O=2NaOH+H2↑、2NaOH+CuCl2=Cu(OH)2↓+2NaCl,既有Na与H2O反应现象,又有NaOH与CuCl2反应现象,然后根据产物推断产生哪些现象.
解答 解:钠投入到盛有氯化铜溶液的烧杯里,发生反应有:2Na+2H2O=2NaOH+H2↑、2NaOH+CuCl2=Cu(OH)2↓+2NaCl,既有Na与H2O反应现象,又有NaOH与CuCl2反应现象.所以现象为:钠浮在液面上,与溶液剧烈反应,熔成小球,四处游动,发出嘶嘶声,有气泡冒出,有蓝色沉淀生成,所以为A、B、C选项错误,D正确;
故选:D.
点评 本题考查的是钠的化学性质,在金属活动性顺序表中,前边的金属能置换后边的金属,但钾、钙、钠三种金属金属性很强,能和水发生置换反应,所以与后边的金属盐溶液反应时,先和水反应生成碱,碱再和盐反应,所以不能置换后边的金属.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.氯仿(CHCl3)可用作麻醉剂,但常因保存不慎而被空气氧化,产生光气.2CHCl3+O2═2HCl+2COCl2(光气),光气有剧毒.为防止事故发生,用以检验氯仿是否变质的试剂是( )
| A. | 澄清石灰水 | B. | 硝酸银溶液 | C. | 漂白粉溶液 | D. | 氢氧化钠溶液 |
8.下列说法正确的是( )
| A. | 苯、溴水、铁粉混合制成溴苯 | |
| B. | C4H10有三种同分异构体 | |
| C. | 乙醇和乙醛均能发生氧化反应生成乙酸 | |
| D. | 丙烯与HCl在一定条件下能加成只得到一种产物 |
5.常温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量,请分析上述实验过程,并回答下列问题:
(1)该反应的离子方程式为:NH3•H2O+H+=NH4++H2O.
(2)在实验过程中,水的电离程度的变化趋势是先增大后减小.(选填“增大”、“减小”、或“不变”)
(3)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH值,请将表中空格部分填上相应的内容,将表格补充完整:
(1)该反应的离子方程式为:NH3•H2O+H+=NH4++H2O.
(2)在实验过程中,水的电离程度的变化趋势是先增大后减小.(选填“增大”、“减小”、或“不变”)
(3)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH值,请将表中空格部分填上相应的内容,将表格补充完整:
| 离子浓度从大到小的顺序 | 溶质化学式 | 溶液的pH值 |
| c(NH4+)>c(OH-)>c(Cl-)>c(H+) | NH4Cl、NH3.H2O | >7 |
| c(NH4+)=c(Cl-)>c(H+)=c(OH-) | NH4Cl、NH3.H2O | =7 |
c(Cl-)>c(NH4+)>c(H+)>c(OH-) | NH4Cl | <7 |
| c(Cl-)>c(H+)>c(NH4+)>c(OH-) | NH4Cl HCl | <7 |
2.图中能组成原电池产生电流的是( )
| A. | 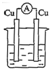 稀硫酸 | B. | 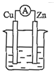 稀硫酸 | C. | 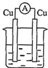 酒精 | D. | 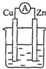 ZnSO4 |
6.我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如表:
请回答下列问题:(用A、B、C、D、E,所对应的元素符号作答)
(1)D位于周期表中p区,E的核外电子排布式是1s22s22p63s23p63d104s1
(2)B、C、D第一电离能由大到小为N>O>C
(3)A和C形成的常见分子中,中心原子的杂化方式为sp3
(4)1molABC分子中含有σ键数目为2NA
(5)与化合物BD互为等电子体的阴离子化学式为CN-;
(6)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层P轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
(1)D位于周期表中p区,E的核外电子排布式是1s22s22p63s23p63d104s1
(2)B、C、D第一电离能由大到小为N>O>C
(3)A和C形成的常见分子中,中心原子的杂化方式为sp3
(4)1molABC分子中含有σ键数目为2NA
(5)与化合物BD互为等电子体的阴离子化学式为CN-;
(6)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
7.一定条件下,对于含有一定数目分子的气体,决定其体积的主要因素是( )
| A. | 气体分子间的平均距离 | B. | 气体的分子的形状 | ||
| C. | 气体分子本身的大小 | D. | 气体分子的种类 |
