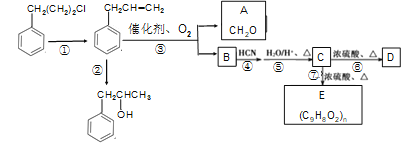
题目内容
【题目】向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N。若向M、N溶液中逐滴加入浓度为0.25mol·L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B。
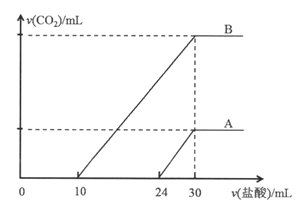
请回答下列问题:
(1)NaOH溶液的物质的量浓度为_____________。
(2)M、N两溶液中相同组分溶质的物质的量之比为_________。
【答案】 0.25mol·L-1 3:5
【解析】本题分析:氢氧化钠溶液与二氧化碳反应的可能产物为碳酸钠、碳酸氢钠及水。M、N两溶液中加入盐酸时发生反应:①HCl+NaOH=NaCl+H2O 、②Na2CO3+HCl=NaCl+NaHCO3、③NaHCO3+HCl=NaCl+H2O+CO2↑ 。碳酸钠与盐酸反应时,先发生反应②,再发生反应③,而且两反应消耗氯化氢的物质的量等于氯化钠的物质的量。
(1)当加入30mL盐酸时,恰好形成氯化钠溶液,NaOH溶液的物质的量浓度等于稀盐酸的物质的量浓度为0.25mol·L-1(2)M、N两溶液中分别依次发生反应①②③、②③,M、N两溶液中相同组分溶质是碳酸钠,两部分碳酸钠的物质的量之比为6:10=3:5。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目