题目内容
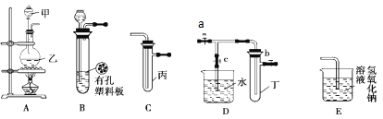
【题目】Ⅰ.如图为原电池装置示意图。
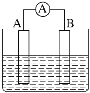
(1)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,写出B电极反应式:__________。该电池在工作时,A电极的质量将_______(填“增加”“减小”或“不变”),若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为________。
(2)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____________________________。该电池在工作一段时间后,溶液的碱性将________(填“增强”“减弱”或“不变”)。
Ⅱ.现用图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1000 mL,供选择的电极材料有纯铜片和纯锌片。
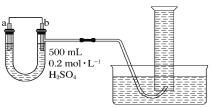
(3)b电极材料为________,其电极反应式为_________________________。
(4)当量筒中收集到560 mL(标准状况下)气体时,通过导线的电子的物质的量为________mol,此时a电极质量________(填“增加”或“减少”)________g。
(5)如果将a、b两电极的电极材料对调,U形管中将出现的现象是_____________。
【答案】PbO2+SO42-+4H++2e-=PbSO4+2H2O 增加 0.1NA H2+2OH--2e-=2H2O 减弱 铜 2H++2e-=H2↑ 0.05 减少 1.625 左端液面下降,右端液面上升
【解析】
(1)若A为Pb,B为PbO2,则A电极为负极,B电极为正极,在B电极,PbO2得电子生成的产物与电解质作用生成PbSO4和H2O。该电池在工作时,A电极由Pb转化为PbSO4,由电极总反应可得出Pb——2H2SO4——2e-,由此可计算出反应消耗0.1 mol H2SO4时转移电子的数目。
(2) A电极通H2,为负极,H2失电子生成的产物与OH-反应最终生成水。该电池的总反应为2H2+O2==2H2O,工作一段时间后,碱的物质的量不变,但水的量增多。
(3)从图中可以看出,b电极生成H2,则b电极为正极,H+得电子生成H2。
(4)a电极、电子、气体的关系式为Zn——2e-——H2,由此可计算出电子的物质的量和电极的质量变化。
(5)如果将a、b两电极的电极材料对调,则a电极为正极,生成的H2因不能逸出,而使左端液面下降。
(1)若A为Pb,B为PbO2,则A电极为负极,B电极为正极,在B电极,PbO2得电子生成的产物与电解质作用生成PbSO4和H2O,电极反应式为PbO2+SO42-+4H++2e-=PbSO4+2H2O。该电池在工作时,A电极由Pb转化为PbSO4,则A电极的质量将增大;由电极总反应可得出Pb——2H2SO4——2e-,可计算出反应消耗0.1 mol H2SO4时转移电子的数目为0.1NA。答案为:PbO2+SO42-+4H++2e-=PbSO4+2H2O;增大;0.1NA;
(2) A电极通H2,为负极,H2失电子生成的产物与OH-反应最终生成水,A电极反应式为H2+2OH--2e-=2H2O。该电池的总反应为2H2+O2==2H2O,工作一段时间后,KOH的物质的量不变,但水的量增多,溶液体积增大,所以溶液的碱性将减弱。答案为:H2+2OH--2e-=2H2O;减弱;
(3)从图中可以看出,b电极生成H2,则b电极为正极,b电极材料为铜,H+得电子生成H2,其电极反应式为2H++2e-=H2↑。答案为:铜;2H++2e-=H2↑;
(4)量筒中收集到560 mL(标准状况下)气体时,n(H2)=![]() =0.025mol,a电极、电子、气体的关系式为Zn——2e-——H2,由此可计算出电子的物质的量为0.025mol×2=0.05mol,Zn电极溶解,质量减少,减少的质量为0.025mol×65g/mol=1.625g。答案为:0.05;减少;1.625;
=0.025mol,a电极、电子、气体的关系式为Zn——2e-——H2,由此可计算出电子的物质的量为0.025mol×2=0.05mol,Zn电极溶解,质量减少,减少的质量为0.025mol×65g/mol=1.625g。答案为:0.05;减少;1.625;
(5)如果将a、b两电极的电极材料对调,则a电极为正极,生成的H2因不能逸出,而使左端液面下降,右端液面上升。答案为:左端液面下降,右端液面上升。

【题目】化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验装置与实验目的对应的是( )
|
|
|
|
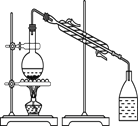
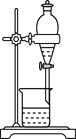
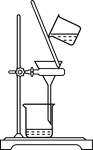
A用海水制蒸馏水 | B将碘水中的碘单质与水直接分离 | C除去Fe(OH)3胶体中的FeCl3 | D稀释浓硫酸 |
A.AB.BC.CD.D
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K1、K2、K3之间的关系为K3=____________。
(2)T℃时,2NO(g)+Cl2(g)![]() 2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | υ/mol·L-1· s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=__________;k=___________(注明单位)。
(3)在2 L的恒容密闭容器中充入4 mol NO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图I。
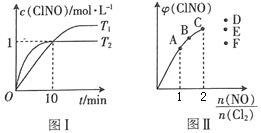
① 温度为T1时,能作为该反应达到平衡的标志的有__________。
a.气体体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.υ(ClNO)=υ(NO) f.NO与ClNO的物质的量比值保持不变
② 反应开始到10min时,Cl2的平均反应速率υ(Cl2)=_______________。
③ 温度为T2时,10 min时反应已经达到平衡,该反应的平衡常数K=____________。
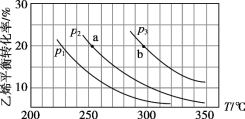
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随![]() 的变化如图II,则A、B、C三个状态中,NO的转化率最小的是____点,当
的变化如图II,则A、B、C三个状态中,NO的转化率最小的是____点,当![]() 时,达到平衡状态时ClNO的体积分数φ可能是D、E、F三点中的_____点。
时,达到平衡状态时ClNO的体积分数φ可能是D、E、F三点中的_____点。