题目内容
【题目】目前,对碳、氮及化合物的研究备受关注。已知:
I.2C(s)+2NO(g)![]() N2(g)+2CO(g)
N2(g)+2CO(g) ![]() =-414.8kJ/mol
=-414.8kJ/mol
II.2CO(g)+O2(g)![]() 2CO2 (g)
2CO2 (g)![]() =-566kJ/mol
=-566kJ/mol
III.2CO(g)+2NO(g)![]() N2(g)+2CO2 (g)
N2(g)+2CO2 (g)![]() =-759.8kJ/mol
=-759.8kJ/mol
回答下列问题:
(l) N2的电子式为 ___ 。
(2)表示碳的燃烧热的热化学方程式为____。
(3)某催化剂的M型、N型均可催化反应2CO(g)+O2 (g)=2CO2 (g)。向容积相同的恒容密闭容器中分别充入等量的CO和O2,在相同时间段内,不同温度下测得CO的转化率(a)如图所示。

①由图推断下列说法正确的是 ___(填选项字母)。
A.a、b、c、d点均达到平衡状态B.该反应的平衡常数K(b)=K(c)
C.b点反应物的有效碰撞几率最大D.图中五个点对应状态下,a点反应速率最慢
②e点CO的转化率突然减小的可能原因为_______________________
③若b点容器中c(O2)=0.5 mol·L-l,则To℃时该反应的平衡常数K=________
(4) T1℃时,向刚性容器中充入2 mol NO和2 mol CO,发生反应Ⅲ。5 min时达到平衡状态,测得容器中n(N2) =0.8 mol、c(CO2)=0. 32 mol/L。
①0~5 min内,用NO表示的反应速率v(NO)=_________
②反应进行到2 min时,v正(CO) ___v逆(CO2)(填“>”“<”或“=”)。
③若升高温度,容器内气体压强____(填“增大”“减小”或“不变”),原因为 ___。
【答案】![]() C (s)+O2(g)=== CO2(g) ΔH=-393.5 kJ·mol-1 BD 催化剂失去活性
C (s)+O2(g)=== CO2(g) ΔH=-393.5 kJ·mol-1 BD 催化剂失去活性 ![]() 0.064 mol·L-1·min-1 > 增大 升高温度,容积不变,压强增大(或反应III为气体体积分数减小的放热反应,温度升高,平衡逆向移动,气体总的物质的量增大,压强增大)
0.064 mol·L-1·min-1 > 增大 升高温度,容积不变,压强增大(或反应III为气体体积分数减小的放热反应,温度升高,平衡逆向移动,气体总的物质的量增大,压强增大)
【解析】
(1)氮原子核外电子数为5,形成氮分子时共用3对电子对达到8电子稳定结构;
(2)燃烧热是指1 mol可燃物完全燃烧生成稳定氧化物放出的热量;结合已知的热化学方程式,利用盖斯定律作答;
(3)①A. b点之前,CO的转化率随着温度的升高不断增大,反应向正向移动,因该反应为放热反应,b点之后,温度升高会使平衡向逆向移动,不利于CO的转化,据此作答;
②转化率突然减小,可能跟催化剂的活性有关;
③b点达到平衡状态,![]() (NO) = 0.4,设起始投入的CO和O2的物质的量浓度均为x mol/L,结合化学平衡常数的定义及三段式列式计算;
(NO) = 0.4,设起始投入的CO和O2的物质的量浓度均为x mol/L,结合化学平衡常数的定义及三段式列式计算;
(4)①依据![]() =
= ![]() 可知,各物质表示的化学反应速率之比等于相同时间内转化的各物质的浓度之比,也等于与之对应的化学计量数之比,据此分析作答;
可知,各物质表示的化学反应速率之比等于相同时间内转化的各物质的浓度之比,也等于与之对应的化学计量数之比,据此分析作答;
②反应进行到2 min时,为达到平衡,反应向正向进行;
③恒容体系中,容器内的压强与气体的物质的量成正比,结合温度对反应的影响效果解答。
(1)氮气分子内含共价三键,其电子式为:![]() ;
;
故答案为:![]() ;
;
(2)已知I.2C(s)+2NO(g)![]() N2(g)+2CO(g)
N2(g)+2CO(g) ![]() =-414.8kJ/mol
=-414.8kJ/mol
II.2CO(g)+O2(g)![]() 2CO2 (g)
2CO2 (g)![]() =-566kJ/mol
=-566kJ/mol
III.2CO(g)+2NO(g)![]() N2(g)+2CO2 (g)
N2(g)+2CO2 (g)![]() =-759.8kJ/mol
=-759.8kJ/mol
则![]() (I + 2 II - III)可得C (s)+O2(g)=== CO2(g),其反应热ΔH=
(I + 2 II - III)可得C (s)+O2(g)=== CO2(g),其反应热ΔH=![]() ×[-414.8kJ/mol +2×(-566kJ/mol)-(-759.8kJ/mol) =)] = -393.5 kJ·mol-1,
×[-414.8kJ/mol +2×(-566kJ/mol)-(-759.8kJ/mol) =)] = -393.5 kJ·mol-1,
故答案为:C (s)+O2(g)=== CO2(g) ΔH=-393.5 kJ·mol-1;
(3)①A. b点之前,CO的转化率随着温度的升高不断增大,反应向正向移动,因该反应为放热反应,b点之后,温度升高会使平衡向逆向移动,不利于CO的转化,则b点达到平衡状态,而a、c点未达到平衡状态,d点为平衡后相应温度下对应的CO的转化率,故A项错误;
B. 催化剂可改变反应速率,但不会改变平衡,该反应的平衡常数为定值,即该反应的平衡常数K(b)=K(c),故B项正确;
C. 化学反应速率随着温度的升高而加快,则有效碰撞几率也会随之增大,图中e点的有效碰撞几率最大,故C项错误;
D. 图中五个点对应状态下,a点对应的温度最低,则反应速率最慢,故D项正确;
答案为BD; ②催化剂的催化活性对温度要求较高,若温度过高,催化剂可能会失去活性,导致反应减慢,CO的转化率突然减小, 故答案为:催化剂失去活性; ③b点达到平衡状态, 因c(O2)=0.5 mol·L-l,则0.8x = 0.5 mol·L-l,x = 0.625 mol/L, 平衡常数K = 故答案为: (4)①因反应为2CO(g)+2NO(g) 故答案为:0.064 mol·L-1·min-1; ②依据题意可知,反应进行到2 min时,还未达到平衡,该反应向正向移动,则v正(CO) > v (CO2), 故答案为:>; ③反应III为气体体积分数减小的放热反应,温度升高,平衡逆向移动,气体总的物质的量增大,则压强增大,即升高温度,容积不变,压强增大, 故答案为:增大;升高温度,容积不变,压强增大(或反应III为气体体积分数减小的放热反应,温度升高,平衡逆向移动,气体总的物质的量增大)。![]() (NO) = 0.4,设起始投入的CO和O2的物质的量浓度均为x mol/L,
(NO) = 0.4,设起始投入的CO和O2的物质的量浓度均为x mol/L,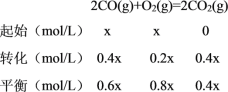
![]() =
= ![]() =
= ![]() =
= ![]() ,
,![]() ;
;![]() N2(g)+2CO2 (g),反应的NO的浓度
N2(g)+2CO2 (g),反应的NO的浓度![]() c(NO) =
c(NO) = ![]() c(CO2)=0. 32 mol/L-0 mol/L = 0. 32 mol/L,所以v(NO)=
c(CO2)=0. 32 mol/L-0 mol/L = 0. 32 mol/L,所以v(NO)=![]() =
= ![]() = 0.064 mol·L-1·min-1,
= 0.064 mol·L-1·min-1,

【题目】下列对实验事实的解释错误的是
选项 | 实验事实 | 解释 |
A | 用容量瓶配制一定浓度的溶液,定容时仰视读数使所配溶液浓度偏低 | 溶液凹液面最低处高于刻度线 |
B | 用标准硝酸银溶液滴定溶液中氯离子时,标准液盛放在棕色滴定管中 | 硝酸银见光分解 |
C | 向10mL 0.5mol/L的氯化镁溶液中滴加5mL 2.4mol/L氢氧化钠溶液,产生白色沉淀再滴加氯化铜溶液,沉淀变蓝 | Ksp[Cu(OH)2 ]<Ksp[Mg(OH)2 ] |
D | 长时间存放的漂白粉的试剂瓶可用稀盐酸清洗 | 漂白粉在空气中转化为碳酸钙能溶于盐酸 |
A. AB. BC. CD. D