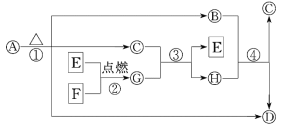
题目内容
【题目】利用海水可以提取溴和镁,提取过程如下:

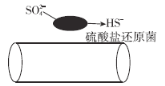
(1)提取溴的过程中,经过2次Br-→Br2转化的目的是_______,吸收塔中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-,蒸馏塔中发生反应的离子方程式是_____。
(2)从MgCl2溶液中得到MgCl26H2O晶体的主要操作是_________、冷却结晶、过滤、洗涤、干燥。由无水氯化镁得到镁的化学方程式是___。
(3)海水提取镁要用到海滩上的贝壳,贝壳的作用是:_______,贝壳经历变化的化学方程式为:____,CaO+H2O = Ca(OH)2
(4)六水合氯化镁脱水变成无水氯化镁的工艺条件是:____
【答案】对溴元素进行富集 Cl2+2Br-=2Cl-+Br2 加热浓缩 MgCl2(熔融)![]() Mg+Cl2↑ 贝壳主要成分是CaCO3,能转化为Ca(OH)2 CaCO3
Mg+Cl2↑ 贝壳主要成分是CaCO3,能转化为Ca(OH)2 CaCO3 ![]() CaO + CO2↑ 在氯化氢气流加热蒸发脱水
CaO + CO2↑ 在氯化氢气流加热蒸发脱水
【解析】
(1)海水中含有溴元素的浓度低,提取溴时,需要富集,即经过2次Br-→Br2转化的目的是富集溴元素;根据流程,蒸馏塔中通入氯气,从吸收塔出来的溶液中含有Br-,即蒸馏塔中发生反应的离子方程式为Cl2+2Br-=2Cl-+Br2;
(2)MgCl2→MgCl2·6H2O操作是加热浓缩、冷却结晶、过滤等步骤;工业上电解熔融状态的氯化镁冶炼金属镁,化学反应方程式为:MgCl2(熔融) ![]() Mg+Cl2↑;
Mg+Cl2↑;
(3)贝壳中含有碳酸钙,煅烧贝壳可以得到CaO,CaO与水反应生成Ca(OH)2,与Mg2+反应生成Mg(OH)2;煅烧碳酸钙的反应方程式为CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(4)六水合氯化镁脱水变成无水氯化镁,为抑制Mg2+水解,因此六水合氯化镁脱水变成无水氯化镁的工艺条件在氯化氢气流中加热蒸发脱水。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑧ | ||||||
3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),得电子能力最强的原子是______,失电子能力最强的单质与水反应的化学方程式__。
(2)元素④的离子结构示意图为___________。
(4)写出③的单质置换出⑥的单质的化学方程式:_____。
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为________。
②的最高价氧化物对应水化物与⑤的最高价氧化物反应的化学方程式为________。