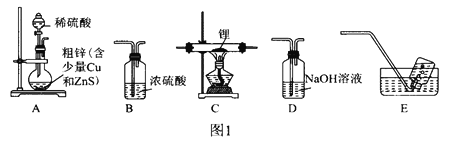
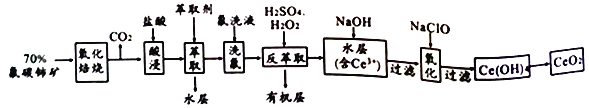
题目内容
【题目】按要求填写下列相关内容:
(1)在常温下,将体积为 VaL、pH 为 a 的稀硫酸和体积为 VbL、pH为 b 的烧碱溶液混合,若所得混合液为中性。如果 a+b=15,则 Va:Vb=_______。某温度时,水的离子积常数 Kw=1×10-13.在此温度下,将 pH=a 的硫酸溶液 VaL与 pH=b的 NaOH 溶液 VbL 混合,若所得混合液为中性,如果 a+b=12,则 Va:Vb=_______。
(2)中和相同体积,相同 pH 的 Ba(OH)2、NH3·H2O、NaOH 三种稀溶液所用相同浓度的盐酸的体积分别为 V1、V2、V3,则三种关系为______________(用“V1、V2、V3”和“>、<、=”表示)。
(3)常温下将 0.2mol/LHCl 溶液与 0.2mol/LMOH 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 pH=6,试回答以下问题:
①0.2mol/LHCl 溶液中由水电离出的 c(H+)______0.2mol/LMOH 溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_______mol/L。
③已知 Ksp(CaCO3)=2.8×10-9mol2·L-2. 现将 CaCl2 溶液与 0.02 mol·L-1Na2CO3 溶液等体积混合,生成 CaCO3 沉淀时,所需 CaCl2 溶液的最小物质的量浓度为______mol/L。
【答案】 10∶1(或 10) 1∶10 V2﹥V3=V1 < 9.9×10-7 5.6×10-7
【解析】(1)体积为VaL、pH值为a的稀硫酸和体积为VbL,pH值为b的烧碱溶液混和,若所得混合液为中性。说明氢离子和氢氧根离子恰如完全反应,得到:Va×10-a=Vb×10b-14,如果a+b=15,计算得到Va:Vb =10-14+a+b=101=10:1;若所得混合溶液为中性,pH=b的NaOH溶液中c(H+)=10-bmol/L,c(OH-)=![]() mol/L,pH=a的硫酸溶液中c(H+)=10-amol/L,因c(H+)×Va=c(OH-)×Vb,则10-a×Va=
mol/L,pH=a的硫酸溶液中c(H+)=10-amol/L,因c(H+)×Va=c(OH-)×Vb,则10-a×Va=![]() mol/L×Vb,结合a+b=12整理可得:Va:Vb=1:10;(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,滴加等浓度的盐酸将它们恰好中和,用去酸的体积V1=V3,但NH3H2O为弱碱,等pH时,其浓度大于NaOH,滴加等浓度的盐酸将它们恰好中和,弱碱继续电离产生氢氧根离子,则消耗酸多,即V2>V3,所以消耗酸的体积关系为:V2>V3=V1;(3)HCl与MOH的物质的量相等,二者混合恰好反应得到MCl溶液,混合后溶液的pH=6,说明MOH为弱碱。①HCl溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度为
mol/L×Vb,结合a+b=12整理可得:Va:Vb=1:10;(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,滴加等浓度的盐酸将它们恰好中和,用去酸的体积V1=V3,但NH3H2O为弱碱,等pH时,其浓度大于NaOH,滴加等浓度的盐酸将它们恰好中和,弱碱继续电离产生氢氧根离子,则消耗酸多,即V2>V3,所以消耗酸的体积关系为:V2>V3=V1;(3)HCl与MOH的物质的量相等,二者混合恰好反应得到MCl溶液,混合后溶液的pH=6,说明MOH为弱碱。①HCl溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度为![]() mol/L,0.2mol/LMOH溶液中c(OH-)<0.2mol/L,则溶液中水电离的氢离子浓度大于
mol/L,0.2mol/LMOH溶液中c(OH-)<0.2mol/L,则溶液中水电离的氢离子浓度大于![]() mol/L,故0.2mol/LHCl溶液中由水电离出的c(H+)<0.2mol/LMOH溶液中由水电离出的c(H+);②根据电荷守恒:c(Cl-)+c(OH-)=c(M+)+c(H+),则c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8mol/L=9.9×10-7mol/L;③Na2CO3溶液的浓度为2×10-2mol/L,等体积混合后溶液中c(CO32-)=
mol/L,故0.2mol/LHCl溶液中由水电离出的c(H+)<0.2mol/LMOH溶液中由水电离出的c(H+);②根据电荷守恒:c(Cl-)+c(OH-)=c(M+)+c(H+),则c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8mol/L=9.9×10-7mol/L;③Na2CO3溶液的浓度为2×10-2mol/L,等体积混合后溶液中c(CO32-)=![]() ×2×10-2mol/L=1×10-2mol/L,根据Ksp(CaCO3)=c(CO32-)c(Ca2+)=2.8×10-9可知,c(Ca2+)=
×2×10-2mol/L=1×10-2mol/L,根据Ksp(CaCO3)=c(CO32-)c(Ca2+)=2.8×10-9可知,c(Ca2+)=![]() mol/L=2.8×10-7mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-7mol/L=5.6×10-7mol/L。
mol/L=2.8×10-7mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-7mol/L=5.6×10-7mol/L。

【题目】为探究 H2O2、SO2、Br2 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)
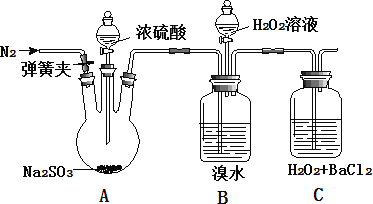
实验操作 | 实验现象 |
i. 打开 A 中分液漏斗活塞,滴加浓硫酸 | A 中有气泡产生,B 中红棕色褪色,C 中有白色沉淀 |
ii. 取 C 中沉淀加入盐酸 | C 中白色沉淀不溶解 |
iii. 打开B 中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加 H2O2 溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A 中发生反应的化学方程式是_____。
(2)B 中红棕色褪色的离子方程式是_____。
(3)甲同学通过 C 中产生白色沉淀,得出结论,氧化性:H2O2>SO2。C 中产生白色沉淀的离子方程式是_____。
①乙同学认为不能得出此结论, 认为在滴加浓硫酸之前应增加一步操作, 该操作是_____。
②丙同学认为还应该在 B 和 C 之间增加洗气瓶 D,D 中盛放的试剂是_____。
③将乙和丙同学改进后的方案进行实验,C 中产生白色沉淀,得出结论:氧化性 H2O2>SO2。
(4)iii 中滴入少量 H2O2 没有明显变化。提出假设:
观点 1:H2O2 的量少不能氧化溴离子
观点 2:B 中有未反应 SO2
为验证观点 2,应进行的实验操作及现象是_____。
(5)通过上述全部实验,得出结论:H2O2、SO2、Br2 氧化性由强到弱的顺序是_____。