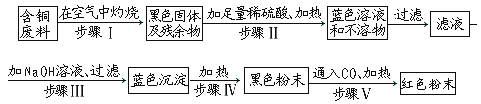
题目内容
【题目】下列反应中,产生氢气速度最快的是( )
A.常温下铝与6mol/L的硝酸B.常温下镁与3mol/L的醋酸
C.常温下铁与3mol/L的盐酸D.常温下镁与3mol/L的硫酸
【答案】D
【解析】
A.常温下硝酸具有强的氧化性,与铝反应不能产生氢气,A错误;
B.醋酸是一元弱酸,溶液中氢离子的浓度小于等物质的量浓度的一元强酸盐酸,所以其反应产生氢气速率不是最快,B错误;
C.盐酸是一元强酸,铁与盐酸反应产生氢气的速率比等浓度的二元强酸小,所以反应产生氢气速度不是最快,C错误;
D.由于金属活动性Mg>Fe,而且溶液中氢离子的浓度硫酸大于盐酸,所以常温下镁与3mol/L的硫酸反应产生氢气的速率最快,D正确。
答案选D。

【题目】已知25 ℃时,部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)用离子方程式表示Na2CO3溶液呈碱性的原因:____________________。
(2)等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3溶液的pH由大到小的顺序为____________________________________(填字母)。
(3)已知在25℃时, 将HCN溶液与NaOH溶液等体积等浓度混合后,此溶液中离子浓度由大到小的顺序是____________________________________。
(4)常温下,0.1mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(5)体积均为10 mL ,pH均为2的醋酸溶液与盐酸分别与足量Zn反应,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
【答案】 CO32-+H2O HCO3-+OH- C>B>D>A c(Na+)>c(CN-)>c(OH-)>c(H+) B = <
【解析】(1). Na2CO3是强碱弱酸盐,碳酸根离子发生水解:CO32-+H2O HCO3-+OH-,使溶液呈碱性,故答案为:CO32-+H2O HCO3-+OH-;
(2).由表中数据可知,酸性强弱顺序为:CH3COOH> H2CO3> HCN>HCO3-,根据越弱越水解的规律可知,离子的水解程度:CO32->CN->HCO3->CH3COO-,则等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3四种溶液的pH由大到小的顺序为:C>B>D>A,故答案为:C>B>D>A;
(3).在25℃时,将HCN溶液与NaOH溶液等体积等浓度混合后,二者恰好完全反应,得到NaCN溶液,因Na+不水解而CN-水解,所以c(Na+)>c(CN-),CN-水解使溶液呈碱性,则c(OH-)>c(H+),因盐的水解反应是微弱的,则c(CN-)>c(OH-),所以此溶液中离子浓度由大到小的顺序是:c(Na+)>c(CN-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CN-)>c(OH-)>c(H+);
(4).A.常温下,0.1 mol·L-1的CH3COOH 溶液加水稀释,促进醋酸的电离,使醋酸电离平衡正向移动,n(H+)增大,但c(H+)和c(CH3COO-)减小,故A错误;B. 根据Ka= 可知,
可知, 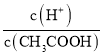 =
= 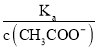 ,根据A项分析可知,c(CH3COO-)减小,因温度不变,则Ka不变,故
,根据A项分析可知,c(CH3COO-)减小,因温度不变,则Ka不变,故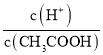 =
= 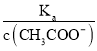 增大,故B正确;C. c(H+)·c(OH-)= Kw,因温度不变,则Kw不变,故c(H+)·c(OH-)也不变,故C错误;答案选B;
增大,故B正确;C. c(H+)·c(OH-)= Kw,因温度不变,则Kw不变,故c(H+)·c(OH-)也不变,故C错误;答案选B;
(5).pH相同的不同醋酸和盐酸中,氢离子浓度相同,反应刚开始时,与Zn反应速率的相同;因醋酸是弱酸,醋酸中酸的浓度大于氢离子浓度,盐酸中酸的浓度等于氢离子浓度,所以醋酸的浓度大于HCl的浓度,则所得氢气的质量:m(H2)盐酸<m(H2)醋酸,故答案为:=;<。
点睛:本题主要考查弱电解质的电离平衡和溶液中微粒浓度的大小比较,题目难度不大。本题的易错点是第(4)小问,分析时既要结合平衡移动原理,也要善于利用平衡常数只与温度有关进行判断,如比较c(H+)/c(CH3COOH)时,可以根据Ka=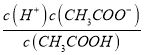 得出:
得出: 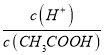 =
= 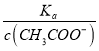 ,再根据c(CH3COO-)减小,因温度不变,则Ka不变,故
,再根据c(CH3COO-)减小,因温度不变,则Ka不变,故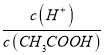 =
= 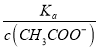 增大,可以快速解决此类问题。
增大,可以快速解决此类问题。
【题型】综合题
【结束】
25
【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的化学试剂。
Ⅰ.测定中和热.
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式__________(中和热数值为57.3kJ/mol)。
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是__________________________。
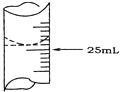
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为___________。
乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.22 | 26.31 |
(3)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________(小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高___________(填序号)。
A.锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定
B.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
C.碱式滴定管用蒸馏水洗涤后立即取用25.00mL待测液注入锥形瓶中进行滴定
D.滴定前俯视滴定管读数,滴定后平视滴定管读数
(5)滴定达到终点的标志是_________________________________________________。