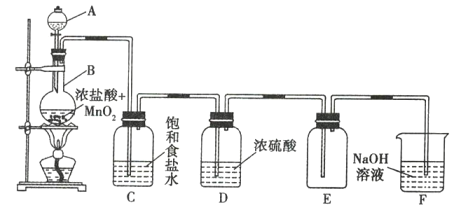
题目内容
【题目】硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2和0.030molO2放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
①从平衡角度分析采用过量O2的目的是___。
②该条件下反应的平衡常数K=___。
③已知:K(300℃)>K(350℃),正反应是___(填“吸”或“放”)热反应。若反应温度升高,SO2的转化率___(填“增大”“减小”或“不变”)。
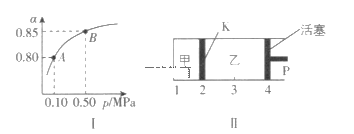
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图I所示。平衡状态由A变到B时,平衡常数K(A)___K(B)(填“大于”“等于”或“小于”,下同)。
(3)如图II所示,保持温度不变,将2molSO2和1molO2加入甲容器中,将4molSO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲___乙。
②若保持乙中压强不变,向甲、乙容器中通人等质量的氦气,达到新平衡时,SO3的体积分数甲___乙。
【答案】提高二氧化硫的转化率 1600 放 减小 = < >
【解析】
(1)①采用过量的O2,可以提高二氧化硫转化率;
②将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040mol/L,则:
2SO2(g)+ O2(g)![]() 2SO3(g)
2SO3(g)
起始浓度(mol/L):0.05 0.03 0
变化浓度(mol/L):0.04 0.02 0.04
平衡浓度(mol/L):0.01 0.01 0.04
再根据K=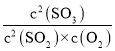 计算平衡常数;
计算平衡常数;
③已知:K(300℃)>K(350℃),升高温度平衡常数减小,说明平衡逆向移动,而升高温度平衡向吸热反应方向移动;
(2)平衡常数只受温度影响,温度不变,平衡常数不变;
(3)①甲为恒温恒容容器,若移动活塞P,使乙的容积和甲相等,为恒温恒容容器,乙中加入4mol三氧化硫相当于加入2mol三氧化硫,再加入2mol三氧化硫,增大压强,平衡正向进行,SO3的体积分数增大;
②甲为恒温恒容容器,加入氦气总压增大,分压不变,平衡不变,乙中加入氦气为保持恒压,体积增大,压强减小,平衡逆向进行,达到新平衡时,SO3的体积分数减小。
(1)①从平衡角度分析采用过量O2的目的是,利用廉价原料提高物质转化率,加入氧气提高二氧化硫的转化率;
②将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040mol/L,则:
2SO2(g)+ O2(g)![]() 2SO3(g)
2SO3(g)
起始浓度(mol/L):0.05 0.03 0
变化浓度(mol/L):0.04 0.02 0.04
平衡浓度(mol/L):0.01 0.01 0.04
平衡常数K=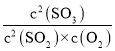 =
=![]() =1600;
=1600;
③K(300℃)>K(350℃),说明温度越高平衡常数越小,反应逆向进行,升温平衡向吸热反应方向进行,正反应为放热反应,升温平衡逆向进行,二氧化硫转化率减小;
(2)平衡常数只受温度影响,与压强无关,平衡状态由A变到B时,二者温度相同,故平衡常数K(A)=K(B);
(3)将2mol SO2和1mol O2加入甲容器中,将4mol SO3加入乙容器中,隔板K不能移动.此时控制活塞P,使乙的容积为甲的2倍,可知甲、乙中最后达到相同的平衡状态;
①若移动活塞P,使乙的容积和甲相等,增大压强,平衡正向进行,SO3的体积分数增大,SO3的体积分数甲<乙;
②甲为恒温恒容容器,加入氦气总压增大,分压不变,平衡不变,乙中加入氦气,为保持恒压,体积增大,压强减小,平衡逆向进行,达到新平衡时,SO3的体积分数减小,SO3的体积分数甲大于乙。

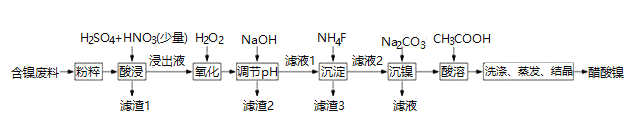
【题目】醋酸镍 ![]() 是一种重要的化工原料,一种以含镍废料
是一种重要的化工原料,一种以含镍废料![]() 含NiS、
含NiS、![]() 、FeO、CaO、
、FeO、CaO、![]() 为原料制取醋酸镍的工艺流程图如下图所示:
为原料制取醋酸镍的工艺流程图如下图所示:
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
金属离子 | 开始沉淀时的pH | 沉淀完全时的pH | 物质 |
|
|
|
|
| 微溶 |
|
|
|
| 可溶 |
|
|
|
| 难溶 |
|
|
|
|
|
![]() 的电子式为_________________。
的电子式为_________________。
![]() 调节pH步骤中,溶液pH的调节范围是_________________。
调节pH步骤中,溶液pH的调节范围是_________________。
![]() 滤渣1和滤渣3主要成分的化学式分别是_________________、_________________。
滤渣1和滤渣3主要成分的化学式分别是_________________、_________________。
![]() 酸浸过程中,lmolNiS失去
酸浸过程中,lmolNiS失去![]() 个电子,同时生成两种无色有毒气体,写出该反应的化学方程式:________。
个电子,同时生成两种无色有毒气体,写出该反应的化学方程式:________。
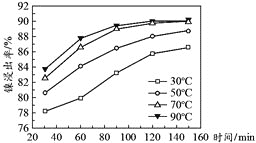
![]() 保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如下图所示,酸浸的最佳温度与时间分别为_________________。
保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如下图所示,酸浸的最佳温度与时间分别为_________________。
![]() 沉镍过程中,若
沉镍过程中,若![]() ,欲使100mL该滤液中的
,欲使100mL该滤液中的![]() 沉淀完全
沉淀完全![]() ,则需要加入
,则需要加入![]() 固体的质量最少为___________
固体的质量最少为___________![]() 保留小数点后2位有效数字
保留小数点后2位有效数字![]() 。
。
![]() 近年来镍氢电池发展很快,它可由
近年来镍氢电池发展很快,它可由![]() 跟
跟![]() 中各元素化合价均可看作是零
中各元素化合价均可看作是零![]() 组成:
组成:![]()
![]()
![]() 。该电池放电时,负极反应是________。
。该电池放电时,负极反应是________。