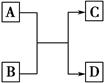
题目内容
A、B、C、D、E五种短周期元素的原子序数依次增大。元素A的负一价离子具有和稀有气体He一样的结构,元素B的最外层电子数是内层电子总数的2倍,元素C是短周期元素中原子半径最大的主族元素,元素D在地壳中的含量位于第二位,元素E与元素B可形成具有正四面体结构的物质。请回答下列问题:
(1)在周期表中,元素B位于第 周期第 族;A与C形成的离子化合物的化学式为 _________________ ; A与C形成的离子化合物与水反应的化学方程式为 。
(2)C形成的简单离子的离子结构示意图为 。
(3)D、E元素形成的化合物可与水反应生成一种沉淀和一种气体,试写出该反应的化学方程式: ___________ 。
(4)单质B与水反应是将B充分利用的措施之一,试写出该反应的化学方程式: ______________________________________ 。
(1)二 ⅣA NaH NaH+H2O=NaOH+H2↑
(2)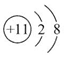
(3)SiCl4+3H2O=H2SiO3↓+4HCl↑
(4)C+H2O(g)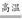 CO+H2
CO+H2
解析

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | ⑤ | | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | | |
①________,②________,⑧________,⑨________。
(2)写出下列反应的化学方程式:
⑦单质跟④的氢氧化物溶液反应:______________________________
⑤的氧化物跟④的氢氧化物溶液反应:________________________________
⑥的单质在③的单质中燃烧:_____________________________________。
部分中学化学常见元素原子结构及性质如下表所示:
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | B原子最外层电子数是内层电子总数的1/5 |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A元素在周期表中的位置为_______________________________________________。
(2)B与C形成的化合物的化学式为_______________________________________,它属于________(填“离子”或“共价”)化合物。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是__________________________________________。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显________________性,N的结构式为______________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱:________________________________________________________。
(5)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写):______________________________________________________________。
I.X、W、Y、Z均为短周期主族元素,原子序数依次增大,X原子的最外层电子数是W的4倍,X、Y在周期表中相对位置如下图。
| X | | |
| | | Y |
(1)X在周期表中的位置是________。
(2)Z单质与石灰乳反应的化学方程式为________。
(3)Y的气态氢化物通入FeCl3溶液中,有Y单质析出,该反应的离子方程式为___。
(4)W-Y高能电池是一种新型电池,它以熔融的W、Y单质为两极,两极之间通过固体电解质传递W+离子。电池反应为:16W(l)+nY8(l)
 8W2Yn(l)。放电时,W+离子向___极移动;正极的电极反应式为________。
8W2Yn(l)。放电时,W+离子向___极移动;正极的电极反应式为________。II.在容积可变的密闭容器中充入A、B、C三种气体,发生反应:x A+yB
 zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表:
zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表: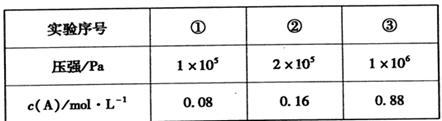
(5)根据①②数据分析得出:x+y ___z(填“>”、“<”或“=”)。
(6)该温度下,当压强为1×106 Pa时,此反应的平衡常数表达式为________。
下表列出了A~R十种元素在周期表中的位置:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | | | | E | R | F | |
| 3 | A | C | D | H | | I | G |
| 4 | B | | | | | | |
请回答下列问题:
(1)写出R单质分子的电子式________。
(2)A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是________(填化学式)。
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为________(用元素的离子符号表示)。
(4)写出A的单质与水反应的化学方程式_____________________________。
(5)X元素是A~R十种元素中的一种,X的原子核里有14个中子,2.7 g X在氧气里燃烧时,质量增加2.4 g。X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应。X的元素符号是________,它位于元素周期表中第________周期第________族。