题目内容
由氢气和氯气组成的混合气体,经光照充分反应后,通入100mL,1mol/L NaOH溶液中,溶液中某种离子的物质的量(图甲)和溶液的导电性(图乙)随着混合气体通入体积的变化而变化.
(1)图甲曲线表示溶液中 离子的变化.
(2)对溶液进行导电性实验时,发现当通入的混合气体体积大于V1时,随着混合气体的通入,溶液导电性明显增强,引起增强的主要阴阳离子是 .
(3)当图甲中n1=0.02mol时,光照前的混合气体中H2和Cl2的物质的量之比为 .
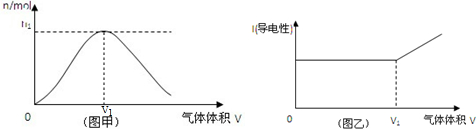
(1)图甲曲线表示溶液中
(2)对溶液进行导电性实验时,发现当通入的混合气体体积大于V1时,随着混合气体的通入,溶液导电性明显增强,引起增强的主要阴阳离子是
(3)当图甲中n1=0.02mol时,光照前的混合气体中H2和Cl2的物质的量之比为

考点:化学方程式的有关计算
专题:计算题
分析:(1)根据图象知,随着混合气体的通入,某种离子的物质的量先增大后减小,如果氯气和氢气恰好反应或氢气过量,氯气和氢气反应后的生成物HCl和NaOH反应,则溶液中Cl-浓度增大,OH-离子浓度减小,不符合题意,则只能是氯气过量,为HCl与氯气混合气体;
(2)ClO-浓度最小,即为其转化为HClO后,再通入气体,溶液导电能力逐渐增大,说明氯气和氢氧化钠溶液反应完全后HCl仍然有剩余,氯化氢溶于水生成盐酸;
(3)当n(ClO-)=0.02 mol时,氢氧化钠完全反应,发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,NaOH+HCl=NaCl+H2O,根据方程式计算反应后氯气、HCl物质的量,再结合H2+Cl2=2HCl计算.
(2)ClO-浓度最小,即为其转化为HClO后,再通入气体,溶液导电能力逐渐增大,说明氯气和氢氧化钠溶液反应完全后HCl仍然有剩余,氯化氢溶于水生成盐酸;
(3)当n(ClO-)=0.02 mol时,氢氧化钠完全反应,发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,NaOH+HCl=NaCl+H2O,根据方程式计算反应后氯气、HCl物质的量,再结合H2+Cl2=2HCl计算.
解答:
解:(1)根据图象知,随着混合气体的通入,某种离子的物质的量先增大后减小,如果氯气和氢气恰好反应或氢气过量,氯气和氢气反应后的生成物HCl和NaOH反应,则溶液中Cl-浓度增大,OH-离子浓度减小,不符合题意,则只能是氯气过量,HCl和Cl2都与NaOH溶液反应,Cl2+2NaOH=NaCl+NaClO+H2O、HCl+NaClO=NaCl+HClO,所以溶液中离子浓度先增大后减小的是ClO-,
故答案为:ClO-;
(2)ClO-浓度最小,即为其转化为HClO后,再通入气体,溶液导电能力逐渐增大,说明氯气和氢氧化钠溶液反应完全后HCl仍然有剩余,氯化氢溶于水生成盐酸,氯化氢在水分子的作用下电离出氢离子和氢氧根离子而使溶液导电性增强,故答案为:Cl-和H+;
(3)氢氧化钠的物质的量=0.1L×1mol/L=0.1mol,
当n(ClO-)=0.02 mol时,氢氧化钠完全反应,则:
Cl2+2NaOH=NaCl+NaClO+H2O,
0.02 mol 0.04 mol 0.02 mol
NaOH+HCl=NaCl+H2O,
(0.1-0.04)mol 0.06 mol
H2 +Cl2 =2 HCl
0.03 mol 0.03 mol 0.06 mol,
因此光照前的混合气体中H2和Cl2的物质的量之比为0.03 mol:(0.02 mol+0.03 mol)=3:5,
故答案为:3:5.
故答案为:ClO-;
(2)ClO-浓度最小,即为其转化为HClO后,再通入气体,溶液导电能力逐渐增大,说明氯气和氢氧化钠溶液反应完全后HCl仍然有剩余,氯化氢溶于水生成盐酸,氯化氢在水分子的作用下电离出氢离子和氢氧根离子而使溶液导电性增强,故答案为:Cl-和H+;
(3)氢氧化钠的物质的量=0.1L×1mol/L=0.1mol,
当n(ClO-)=0.02 mol时,氢氧化钠完全反应,则:
Cl2+2NaOH=NaCl+NaClO+H2O,
0.02 mol 0.04 mol 0.02 mol
NaOH+HCl=NaCl+H2O,
(0.1-0.04)mol 0.06 mol
H2 +Cl2 =2 HCl
0.03 mol 0.03 mol 0.06 mol,
因此光照前的混合气体中H2和Cl2的物质的量之比为0.03 mol:(0.02 mol+0.03 mol)=3:5,
故答案为:3:5.
点评:本题考查化学方程式计算、混合物计算,明确图象中阶段发生的反应是关键,难度较大.

练习册系列答案
相关题目
鉴别NO2气体和Br2蒸气,可用( )
| A、湿润的淀粉KI试纸 |
| B、AgNO3溶液 |
| C、水 |
| D、烧碱溶液 |
下列叙述正确的是( )
| A、48g O3和O2的混合气体中含有6.02×1023个分子 |
| B、常温常压下,4.6g NO2气体含有1.806×1023个原子 |
| C、0.5mol?L-1 1L CuCl2溶液中含有3.01×1023个Cu2+ |
| D、标准状况下,3.36L H2O含有9.03×1023个分子H2O |
科学家在《Science》上发表论文,宣布发现了铝的超原子结构Al13和Al14,当这类超原子具有40个价电子(对于主族元素的原子,外围电子又称为价电子)时最稳定,在质谱仪上可检测到稳定到Al13-和Al142+.下列说法错误的是( )
| A、Al13和Al14互为同位素 |
| B、Al13超原子中Al原子间是通过共价键结合的 |
| C、Al13和Al的化学性质相似,都具有较强的还原性 |
| D、Al14和稀盐酸反应的化学方程式可表示为Al14+2HCl→Al14Cl2+H2↑ |