题目内容
2.工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图1:(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),反应的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(2)在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第Ⅱ步反应,达到平衡后下列关系正确的是AD.
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |
(3)在一个绝热等容容器中,不能判断此流程的第Ⅱ步反应达到平衡的是②③.
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥v(CO2)正=v(H2O)逆
(4)如图2表示此流程的第Ⅱ步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是降低温度、增加水蒸汽的量(或减少氢气的量)(写出两种).若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变).
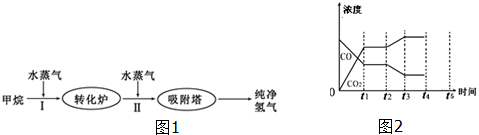
分析 (1)升高温度平衡向吸热反应方向移动,根据温度与化学平衡常数关系确定反应热;根据Qc和K的关系判断反应进行的方向;
(2)A.B、C是完全等效平衡,平衡时各组分的浓度相等,根据投料情况确定浓度关系;
B.B、C相比,建立的平衡的方向是不一样的;
C.根据等效原理,不同的投料,建立的平衡状态下,比较反应物的转化率;
D.根据等效平衡原理以及平衡的建立方向确定转化率关系;
(3)不传热的固定容积的容器中,反应达到平衡的标志是正逆反应速率相同,各成分含量保持不变分析判断选项;
(4)在t2时刻CO的浓度减小、CO2浓度增大,平衡向正反应方向移动,可以通过改变温度、改变水蒸气或氢气的量实现;t4时刻通过改变容积的方法将压强增大为原先的两倍则体积变为原来的一半,故浓度分别增大为原来的2倍,又反应前后气体系数相等,平衡不移动.
解答 解:(1)随着温度的升高,化学平衡常数减小,说明平衡向逆反应方向移动,则正反应是放热反应;400℃时,H2浓度为2mol/L,CO2浓度为1.5mol/L,H2O浓度为3mol/L,CO浓度为1mol/L,则Qc=$\frac{1.5×2}{3×1}$=1<K,所以正向移动,
故答案:放热;正向;
(2)A.B、C是完全等效平衡,平衡时各组分的浓度相等,所以平衡时氢气的浓度c3=c2,但是A的投料量是B、C的2倍,达到平衡时,氢气的浓度是B(C)的2倍,即2c1=c2=c3,故A正确;
B.B、C相比,建立的平衡的方向是不一样的,2Q1<Q2=Q3,故B错误;
C.根据等效原理,不同的投料,建立的平衡状态下,反应物的转化率α1=α3≠α2,故C错误;
D.平衡时对应各组分的含量完全相同,CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,B中平衡时二氧化碳的转化率为α2,平衡时CO的物质的量为α2mol,故(1-α1)=α2,整理得α1+α2=1,故D正确;
故答案为:AD;
(3)在一个绝热等容的容器中,判断此流程的第Ⅱ步反应CO(g)+H2O(g)?H2(g)+CO2(g),达到平衡的标志是正逆反应速率相同;各组分含量保持不变;
①虽然反应前后气体体积不变,但由于绝热等容容器中反应过程中有温度变化,所以压强也在变化,体系的压强不再发生变化能判断反应达到平衡,故①符合;
②反应中混合气体质量守恒,体积不变,密度不变,混合气体的密度不变不能说明反应达到平衡,故②不符合;
③反应前后气体质量守恒,反应前后气体体积不变,物质的量不变,混合气体的平均相对分子质量不变,不能说明反应达到平衡,故③不符合;
④各组分的物质的量浓度不再改变是平衡的标志,故④符合;
⑤体系的温度不再发生变化绝热容器温度不变,说明反应达到平衡,故⑤符合;
⑥反应速率之比等于化学方程式计量数之比,v(CO2)正=v(H2O)逆,说明水蒸气的正逆反应速率相同,故⑥符合;
故答案为:②③;
(3)在t2时刻CO的浓度减小、CO2浓度增大,平衡向正反应方向移动,且CO和CO2浓度变化有接触点,所以可以通过改变降低温度、增大水蒸气的量或减少氢气的量实现;t4时刻通过改变容积的方法将压强增大为原先的两倍,则体积变为原来的一半,故浓度分别增大为原来的2倍,又反应前后气体系数相等,平衡不移动,所以图象仅仅是浓度分别变为原来的2倍并且保持不变,如图为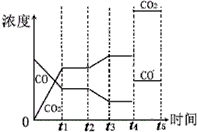 ,故答案为:降低温度;增加水蒸气的量(或减少氢气的量).
,故答案为:降低温度;增加水蒸气的量(或减少氢气的量).
点评 本题考查了化学平衡移动原理,明确化学平衡常数的含义结合化学平衡常数公式进行有关计算,灵活运用三段式法进行解答,会分析图象中曲线变化特点,题目难度很大.

 阅读快车系列答案
阅读快车系列答案| 编号 | 信 息 | 晶体类型 |
| A | 沸点低,易溶于水,水溶液能导电 | 离子晶体 |
| B | 熔点630.74℃,沸点1750℃,液态能导电 | 分子晶体 |
| C | 熔点3410℃,硬度大,固体不能导电 | 金属晶体 |
| D | 由共价键结合成空间网状结构的晶体,熔点高、硬度大,固体不能导电 | 原子晶体 |
| A. | A | B. | B | C. | C | D. | D |