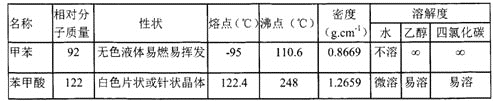
题目内容
【题目】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。
②已知拆开1 molH—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________。
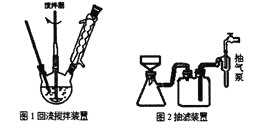
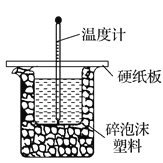
(2)实验室用50 mL 0.50 mol·L-1盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为____________;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择_____________mol·L-1的NaOH溶液进行实验。
【答案】放热 N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92 kJ·mol-1 环形玻璃搅拌棒 0.55
2NH3(g) ΔH=-92 kJ·mol-1 环形玻璃搅拌棒 0.55
【解析】
(1)①ΔH =(生成物的总能E2-反应物的总能量E1)>0,为吸热反应,ΔH=(生成物的总能E2-反应物的总能量E1)<0,为放热反应,因为E1>E2,所以ΔH<0,则该反应为放热反应,故答案为:放热。
②氮气和氢气反应生成氨气,其ΔH=反应物的总键能-生成物总键能=946 kJ·mol-1+3×436 kJ·mol-1-6×391 kJ·mol-1=-92 kJ·mol-1,则N2与H2反应生成NH3的热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92 kJ·mol-1,故答案为:N2(g)+3H2(g)
2NH3(g) ΔH=-92 kJ·mol-1,故答案为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92 kJ·mol-1。
2NH3(g) ΔH=-92 kJ·mol-1。
(2)中和热的测定实验中实验用品:大烧杯(500 mL)、小烧杯(100 mL)、环形玻璃搅拌棒、量筒(50 mL)两个、温度计、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、盐酸(0.50 mol·L1)、氢氧化钠溶液(0.55 mol·L1),盐酸或氢氧化钠的一个需要过量,使另外一个完全中和,实验装置图: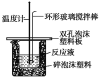 ,由图可知,缺少环形玻璃搅拌棒,用0.55 mol·L-1氢氧化钠,故答案为:环形玻璃搅拌棒;0.55。
,由图可知,缺少环形玻璃搅拌棒,用0.55 mol·L-1氢氧化钠,故答案为:环形玻璃搅拌棒;0.55。

【题目】用如图所示装置检验乙烯时不需要除杂的是( )
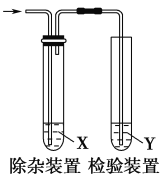
选项 | 乙烯的制备 | 试剂X | 试剂Y |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 溴水 |
A.AB.BC.CD.D
【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+=Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C | 用惰性电极电解NaCl溶液 2Cl-+2H2O | 用惰性电极电解MgBr2溶液 2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性 H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性 H++OH-=H2O |
A.AB.BC.CD.D
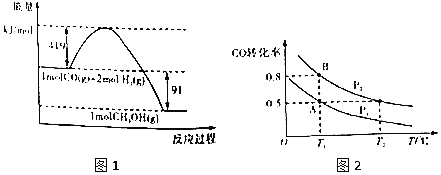
【题目】甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。常温常压下反应的能量变化如图1所示:
CH3OH(g)。常温常压下反应的能量变化如图1所示:
②
化学键 | H—H | H—O | O=O |
键能kJ/mol | 436 | x | 496 |
③CO(g)+ ![]() O2(g)=CO2(g) △H=-280kJ/mol
O2(g)=CO2(g) △H=-280kJ/mol
H2(g)+![]() O2(g)=H2O(l) △H=-284kJ/mol
O2(g)=H2O(l) △H=-284kJ/mol
H2O(l)=H2O(g) △H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为__kJ/mol;
(2)请写出表示气态甲醇燃烧热的热化学方程式__;
(3)H—O的键能x值为__;
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L。如反应开始时仍充入10molCO和30molH2,则在平衡状态B时容器的体积V(B)=___L;
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
平衡时容器体积 | V(甲) | V(乙) | V(丙) |
反应的平衡常数K | K(甲) | K(乙) | K(丙) |
平衡时CH3OH的浓度/molL-1 | C(甲) | C(乙) | C(丙) |
平衡时CH3OH的反应速率/molL-1min-1 | v(甲) | v(乙) | v(丙) |
则下列说法正确的是___。
A.V(甲)>V(丙)
B.K(乙)>K(丙)
C.c(乙)>c(甲)
D.v(甲)=v(丙)