题目内容
在室温下将pH=3的硫酸溶液与pH=12的烧碱溶液混合溶液后溶液pH=11,则硫酸与烧碱溶液的体积之比是
| A.9:2 | B.2:9 | C.9:4 | D.9:1 |
A
混合溶液的pH=11,溶液中的c(OH—)=1×10—3mol·L-1=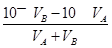 ,解之得:
,解之得: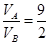 ,答案为A
,答案为A
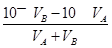 ,解之得:
,解之得: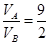 ,答案为A
,答案为A
练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
题目内容
| A.9:2 | B.2:9 | C.9:4 | D.9:1 |
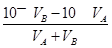 ,解之得:
,解之得: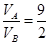 ,答案为A
,答案为A
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案