题目内容
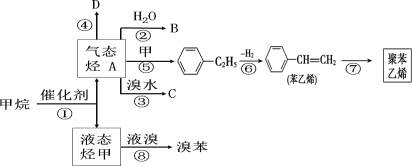
【题目】Ⅰ由白色和黑色固体组成的混合物A,可以发生如下框图所示的一系列变化:
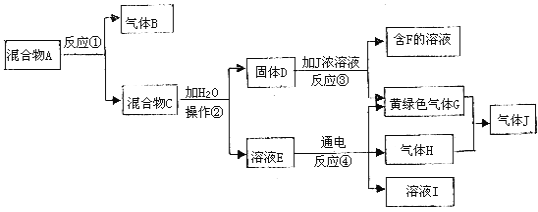
(1)写出反应③的化学方程式:_____________________________________________。写出反应④的离子方程式:_____________________________________________。
(2)在操作②中所使用的玻璃仪器的名称是:____________________________。
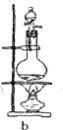
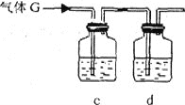
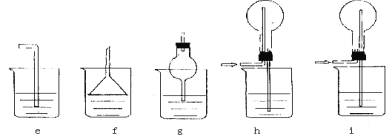
(3)下列实验装置中可用于实验室制取气体G的发生装置是______;(用字母表示)为了得到纯净干燥的气体G,可将气体通过c和d装置,c装置中存放的试剂_____,d装置中存放的试剂______。

(4)气体G有毒,为了防止污染环境,必须将尾气进行处理,请写出实验室利用烧碱溶液吸收气体G的离子方程式:____________________________。
(5)J是一种极易溶于水的气体,为了防止倒吸,下列e~i装置中,可用于吸收J的是____________。
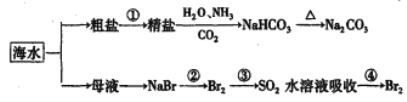
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。

(1)装置③中发生反应的化学方程式为________________________________________
(2)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。
反应原理为3ClO-+I-===3Cl-+IO3- IO3-+5I-+3H2O===6OH-+3I2
实验测得数据如下表所示。该漂白粉中有效成分的质量分数为________________。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
【答案】MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 2Cl-+2H2O
MnCl2+Cl2↑+2H2O 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 漏斗、烧杯、玻璃棒 b 饱和食盐水 浓硫酸 Cl2+2OH-=Cl-+ClO-+H2O f、g、h 2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O 42.9%
Cl2↑+H2↑+2OH- 漏斗、烧杯、玻璃棒 b 饱和食盐水 浓硫酸 Cl2+2OH-=Cl-+ClO-+H2O f、g、h 2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O 42.9%
【解析】
Ⅰ、G为黄绿色气体,则G为Cl2,反应③为二氧化锰与浓盐酸的反应,则D为MnO2,J为HCl,说明混合物A、B中含有MnO2,且含有Cl元素,则A为KClO3、MnO2的混合物,用于实验室制备氧气,则B为O2,C为MnO2、KCl的混合物,则E为KCl,电解KCl溶液生成KOH、Cl2、H2,故H为H2,I为KOH,以此解答该题。
Ⅱ、(1)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,根据温度对该反应的影响分析;
(2)先计算次氯酸钙的质量,再根据质量分数公式计算。
Ⅰ、(1)反应③为实验室制备氯气,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;反应④是电解氯化钾溶液,反应的离子方程式为2Cl-+2H2O
MnCl2+Cl2↑+2H2O;反应④是电解氯化钾溶液,反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
(2)C为MnO2、KCl的混合物,KCl溶于水,而MnO2不溶于水,可利用溶解、过滤方法进行分离,溶解、过滤操作使用的玻璃仪器为漏斗、玻璃棒、烧杯;
(3)实验室用二氧化锰与浓盐酸在加热条件下制备氯气,制取氯气的发生装置是:b,由于浓盐酸易挥发,制备的氯气中含有HCl,先用饱和食盐水吸收氯气,再用浓硫酸进行干燥,即c装置中存放的试剂是饱和食盐水,d装置中存放的试剂为浓硫酸;
(4)实验室利用烧碱溶液吸收气体氯气的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
(5)氯化氢一种极易溶于水的气体,为了防止倒吸,装置中有倒扣的漏斗或肚容式结构,e、i装置不具有防倒吸的作用,而f、g、h具有防倒吸,故答案为fgh;
Ⅱ、(1)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;
(2)3ClO-+I-=3Cl-+IO3- ①; IO3-+5I-+3H2O=6OH-+3I2 ②,这说明真正的滴定反应是第一步,第一步完成后,只要加入少许碘离子就可以和生成的碘酸根生成碘单质而看到浅蓝色达到终点,KI溶液的总体积=(19.98+20.02+20.00)mL=60.00mL,平均体积为60.00mL÷3=20.00mL。设次氯酸根离子的物质的量为x,则根据方程式可知
3ClO-+I-=3Cl-+IO3-
3mol 1mol
x 0.1000molL-1×0.020L
所以x=0.006mol
次氯酸钙的质量为:143g×0.006mol×0.5=0.429g
所以质量分数为0.429g/1.000g×100%=42.9%。

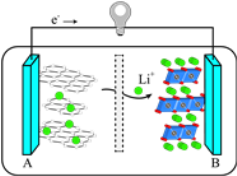
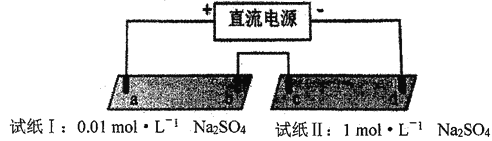
【题目】探究电场作用下阴阳离子的迁移。a、b、c、d 均为石墨电极,电极间距4cm。将pH试纸用不同浓度Na2SO4溶液充分润湿,进行如下实验:
实验现象:
时间 | 试纸I | 试纸II |
lmin | a极附近试纸变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近…… |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
下列说法不正确的是
A. d极附近试纸变蓝
B. a极附近试纸变红的原因是:2H2O+2e-= H2↑+2OH-
C. 对比试纸I和试纸II的现象,说明电解质浓度环境影响H+和OH-的迁移
D. 试纸I的现象说明,此环境中H+的迁移速率比OH-快