题目内容
19.某硫酸厂废气中SO2的回收利用方案如图所示.下列说法不正确的是( )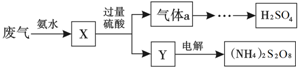
| A. | X可能含有2种盐 | |
| B. | 气体a通入双氧水,可实现“绿色”转化 | |
| C. | Y主要含有(NH4) 2SO4,回收利用作化肥 | |
| D. | (NH4) 2S2O8中S的化合价为+7 |
分析 SO2与氨水反应生成X,则X中含有亚硫酸铵或亚硫酸氢铵中的一种或两种盐;在X中加过量硫酸生成硫酸铵和二氧化硫气体,二氧化硫经氧化、水合等生成硫酸,所以气体a为二氧化硫、Y为硫酸铵;电解硫酸铵溶液可得(NH4)2S2O8,据此进行判断.
解答 解:SO2与氨水反应生成X,则X中含有亚硫酸铵或亚硫酸氢铵中的一种或两种盐,在X中加过量硫酸生成硫酸铵或硫酸氢铵和二氧化硫气体,二氧化硫经氧化、水合等科的硫酸,气体a为二氧化硫,Y为硫酸铵;电解硫酸铵溶液可得(NH4)2S2O8,
A.X中含有亚硫酸铵或亚硫酸氢铵中的一种或两种盐,故A正确;
B.气体a为二氧化硫,二氧化硫被双氧水氧化成硫酸,符合绿色化学的理念,故B正确;
C.根据分析可知,Y的主要成分为硫酸铵,故C正确;
D.(NH4) 2S2O8中,由于S的最高化合价是+6,则不可能为+7,故D错误;
故选D.
点评 本题考查了二氧化硫的污染与防治、元素化合物等知识,题目难度中等,明确二氧化硫的吸收原理、把握物质的主要性质为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
10.下列关于乙酸的说法不正确的是( )
| A. | 食醋中含有3%~5%的乙酸 | |
| B. | 黄酒变酸是因为部分乙醇氧化为乙酸 | |
| C. | 与甲酸甲酯互为同分异构体 | |
| D. | 通过乙酸乙酯的碱性水解直接获取 |
7.化学知识在生产和生活中有着重要的应用.下列说法错误的是( )
| A. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| B. | 明矾常作为净水剂,双氧水通常可用于杀菌消毒 | |
| C. | 金属钠、镁等活泼金属着火时,可以使用泡沫灭火器来灭火 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是硅 |
14.已知25℃时有关弱酸的电离平衡常数如下表:
下列推断正确的是( )
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | HX、HY两种弱酸的酸性:HX<HY | |
| B. | 相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| C. | 结合H+的能力:CO32->Y->X->HCO3- | |
| D. | HX与Na2CO3反应,无气泡产生 |
4.下列实验现象所对应的离子方程式不正确的是( )
| 实验 | 现象 | 离子方程式 | |
| A |  | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2=2I2+2H2O |
| B | 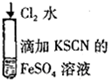 | 溶液由浅绿色变为红色 | 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3 |
| C |  | 溶液由黄绿色变为无色 | Cl2+2OH-=Cl-+ClO-+H2O |
| D |  | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-=BaSO4+H2O |
| A. | A | B. | B | C. | C | D. | D |
11.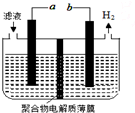 某研究小组利用电化学方法处理石油炼制过程中产生的含H2S的废气.基本工艺是将H2S通入FeCl3溶液中,过滤后将滤液加入电解槽中电解,如图所示,下列有关说法正确的是( )
某研究小组利用电化学方法处理石油炼制过程中产生的含H2S的废气.基本工艺是将H2S通入FeCl3溶液中,过滤后将滤液加入电解槽中电解,如图所示,下列有关说法正确的是( )
 某研究小组利用电化学方法处理石油炼制过程中产生的含H2S的废气.基本工艺是将H2S通入FeCl3溶液中,过滤后将滤液加入电解槽中电解,如图所示,下列有关说法正确的是( )
某研究小组利用电化学方法处理石油炼制过程中产生的含H2S的废气.基本工艺是将H2S通入FeCl3溶液中,过滤后将滤液加入电解槽中电解,如图所示,下列有关说法正确的是( )| A. | 过滤得到的沉淀可能是FeS | |
| B. | 与a极相连的电极反应式为2Cl--2e-=Cl2 | |
| C. | 可以用Fe与外接电源的a极相连 | |
| D. | 电解后的滤液可以循环利用 |
8.下列三种有机物的叙述不正确的是( )
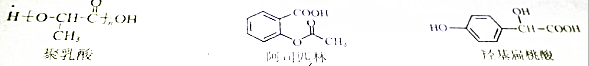

| A. | 三种有机物都能发生酯化反应 | |
| B. | 聚乳酸分子中存在酯基、羧基、羟基 | |
| C. | 羟基扁桃酸在浓硫酸作用下能生成含三个六元环结构的有机物 | |
| D. | 等物质的量的阿司匹林与羟基扁桃酸能消耗的NaOH的量相等 |