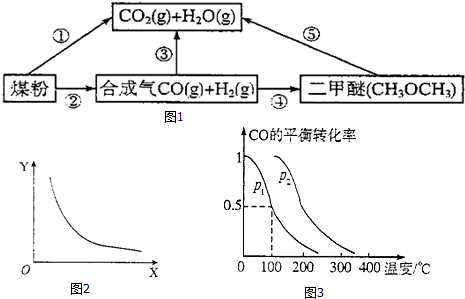
题目内容
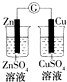
7.化学知识在生产和生活中有着重要的应用.下列说法错误的是( )| A. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| B. | 明矾常作为净水剂,双氧水通常可用于杀菌消毒 | |
| C. | 金属钠、镁等活泼金属着火时,可以使用泡沫灭火器来灭火 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是硅 |
分析 A.铁为负极,铜为正极,发生电化学腐蚀;
B.明矾可水解生成具有吸附性的氢氧化铝,过氧化氢具有强氧化性;
C.二氧化碳可与镁、过氧化钠反应;
D.晶体硅可导电.
解答 解:A.铁比铜活泼,铁为负极,铜为正极,发生电化学腐蚀,钢质水管易发生腐蚀,故A正确;
B.明矾可水解生成具有吸附性的氢氧化铝,可用于净水,过氧化氢具有强氧化性,可用于杀菌消毒,故B正确;
C.二氧化碳可与镁反应生成碳,镁在二氧化碳中燃烧,二氧化碳与过氧化钠反应生成氧气,加速燃烧,应用沙子扑灭,故C错误;
D.晶体硅可导电,可用于太阳能电池板,故D正确.
故选C.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于化学生产、生活的考查,有利于培养学生良好的科学素养,注意把握相关基础知识的积累,难度不大.

练习册系列答案
相关题目
20.下列叙述中正确的是( )
| A. | 25℃,Cu(OH)2在水中的溶度积比其在Cu(NO3)2溶液中的大 | |
| B. | 氨水溶液加水稀释,电离程度增大,c(OH-)增大 | |
| C. | 25℃,为使100mlpH=2的醋酸溶液pH变为3,可加入900ml 水 | |
| D. | CH3COONa溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
15.下列说法正确的是( )
| A. | 自来水厂常用液氯给自来水消毒,主要是因为Cl2具有强氧化性 | |
| B. | 限制大排量汽车,也是防止酸雨的重要途径 | |
| C. | 镀金的钢铁器件既能增加美观,又可以在即使镀层局部破损后防止器件的损耗 | |
| D. | 乙醇可以发生的反应类型有:取代反应、消去反应、加成反应 |
12.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 淀粉溶液、豆浆、雾、碳素墨水均可发生丁达尔现象 | |
| B. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 | |
| C. | 火柴头的主要成分是氯酸钾和硫单质,分别属于电解质和非电解质 | |
| D. | 鸡蛋清溶液中加入CuSO4溶液,有沉淀析出,该性质可用于蛋白质的分离与提纯 |
19.某硫酸厂废气中SO2的回收利用方案如图所示.下列说法不正确的是( )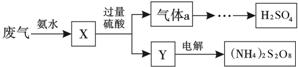

| A. | X可能含有2种盐 | |
| B. | 气体a通入双氧水,可实现“绿色”转化 | |
| C. | Y主要含有(NH4) 2SO4,回收利用作化肥 | |
| D. | (NH4) 2S2O8中S的化合价为+7 |
16.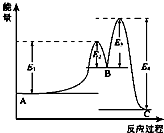 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | 两步反应均为吸热反应 | B. | 加入催化剂会改变反应的焓变 | ||
| C. | 三种化合物中C最稳定 | D. | 整个反应中△H=E1-E4 |
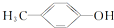 ③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按官能团的不同可分为( )
③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按官能团的不同可分为( )