题目内容
下图是部分短周期元素的常见化合价与原子序数的关系图:

(1)元素A在周期表中的位置 。
(2)用电子式表示D2G的形成过程 ,其所含化学键类型为 。
(3)C2—、D+、G2—离子半径由大到小顺序是 (用离子符号回答)。
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
①溶液a和b分别为 , 。
②溶液c中的离子方程式为 。
③请从原子结构的角度解释非金属性B>A的原因 。

(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中:
①转移电子的物质的量为 。
②用一个离子方程式表示该反应 。

(1)元素A在周期表中的位置 。
(2)用电子式表示D2G的形成过程 ,其所含化学键类型为 。
(3)C2—、D+、G2—离子半径由大到小顺序是 (用离子符号回答)。
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
①溶液a和b分别为 , 。
②溶液c中的离子方程式为 。
③请从原子结构的角度解释非金属性B>A的原因 。

(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中:
①转移电子的物质的量为 。
②用一个离子方程式表示该反应 。
(1)第二周期第ⅣA族(1分)
(2)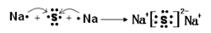 (1分) ,离子键(1分)
(1分) ,离子键(1分)
(3)S2—>O2—>Na+(1分)
(4)①硝酸(或HNO3)(1分), 饱和NaHCO3溶液(1分)
②SiO32-+CO2+H2O =H2SiO3↓+CO32— (写成H4SiO4也给分)(1分)
③碳和氮处于同一周期,氮原子比碳原子:核电荷数大,原子半径小,对最外层电子的吸引能力大,得电子能力强,因此氮元素的非金属性比碳元素强(2分,加点字部分写不出来不给分)
(5)①0.5 mol (1分)②10Na2O2 + 6Al3+ + 6H2O = 4Al(OH)3 + 2AlO2-+ 5O2↑+ 20Na+ (2分)
(2)
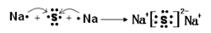 (1分) ,离子键(1分)
(1分) ,离子键(1分)(3)S2—>O2—>Na+(1分)
(4)①硝酸(或HNO3)(1分), 饱和NaHCO3溶液(1分)
②SiO32-+CO2+H2O =H2SiO3↓+CO32— (写成H4SiO4也给分)(1分)
③碳和氮处于同一周期,氮原子比碳原子:核电荷数大,原子半径小,对最外层电子的吸引能力大,得电子能力强,因此氮元素的非金属性比碳元素强(2分,加点字部分写不出来不给分)
(5)①0.5 mol (1分)②10Na2O2 + 6Al3+ + 6H2O = 4Al(OH)3 + 2AlO2-+ 5O2↑+ 20Na+ (2分)
试题分析:由图可知A到G分别为:C、N、O、Na、Al、Si、S。⑷利用非金属元素最高价氧化物对应水化物的酸性强弱,比较三者的非金属性强弱,①硝酸(或HNO3), 饱和NaHCO3溶液
②SiO32-+CO2+H2O =H2SiO3↓+CO32— (写成H4SiO4也给分)(1分)
③碳和氮处于同一周期,氮原子比碳原子:核电荷数大,原子半径小,对最外层电子的吸引能力大,得电子能力强,因此氮元素的非金属性比碳元素强

练习册系列答案
相关题目

 2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
