题目内容
8.设NA为阿伏伽德罗常数,数值约为6.02×1023,下列说法不正确的是( )| A. | 32g S8单质中含有的S-S键个数为6.02×1023 | |
| B. | 12.4g白磷中含有磷原子数为0.4NA | |
| C. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| D. | 0.1mol OH-含NA个电子 |
分析 A.1个S8含有8个s-s键;
B.质量换算物质的量结合白磷的分子结构计算磷原子数;
C.氦气是单原子分子,原子序数为2;
D.根据OH-离子的电子数判断,1个OH-离子含有的电子数为8+1+1=10.
解答 解:A..1个S8含有8个s-s键,32 g S8物质的量为$\frac{1}{8}$mol,含有的σ键物质的量为1mol,个数为6.02×1023,故A正确;
B.白磷分子式为P4,12.4g白磷物质的量=$\frac{12.4g}{4×31g/mol}$=0.1mol,含磷原子为0.4mol,即0.4NA,故B正确;
C.常温常压下,1mol氦气含有的核外电子数为2NA,故C错误;
D.1个OH-离子含有的电子数为8+1+1=10,0.1molOH-含NA个电子,故D正确;
故选:C.
点评 本题考查了阿伏伽德罗常数的应用,主要考查质量换算物质的量,注意物质结构组成,题目难度不大.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
19.下列说法中正确的是( )
| A. | 常温下,浓硫酸、浓硝酸均能将金属铜氧化,且均能使铁钝化 | |
| B. | 乙烯常用作植物催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 | |
| C. | 玛瑙、水晶、钻石的主要成分均为SiO2 | |
| D. | 用CCl4萃取碘水中的I2时,紫色溶液从分液漏斗的上口倒出 |
16.某溶液中含Mg2+,Al3+,Fe3+,SO42-四种离子,加入NaOH溶液至三种金属阳离子刚好全部转化为沉淀,需要含8g NaOH溶质的烧碱溶液,原溶液中SO42-离子的质量为( )
| A. | 9.6g | B. | 9.8g | C. | 19.2g | D. | 无法确定 |
5.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是614C;元素Y与氢元素形成一种分子Y2H4,写出该分子的电子式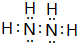 ;
;
(2)用元素符号表示上述四种元素原子半径的相对大小S>Cl>C>N;
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是ab
a、一定条件下Z的单质和T的单质分别与Fe发生反应产物类型不同
b、T的氢化物水溶液在空气中放置容易变质,而Z的氢化物水溶液不易变质
c、元素Z和T的最高价氧化物对应水化物都能与氢氧化钠溶液反应
(4)元素T的氢化物与其最高价氧化物对应的水化物的浓溶液加热条件下反应生成它的一种氧化物,写出该反应的化学方程式H2S+3H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2+4H2O.
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是最内层电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
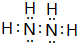 ;
;(2)用元素符号表示上述四种元素原子半径的相对大小S>Cl>C>N;
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是ab
a、一定条件下Z的单质和T的单质分别与Fe发生反应产物类型不同
b、T的氢化物水溶液在空气中放置容易变质,而Z的氢化物水溶液不易变质
c、元素Z和T的最高价氧化物对应水化物都能与氢氧化钠溶液反应
(4)元素T的氢化物与其最高价氧化物对应的水化物的浓溶液加热条件下反应生成它的一种氧化物,写出该反应的化学方程式H2S+3H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2+4H2O.
2.下列说法正确的是( )
| A. | 按系统命名法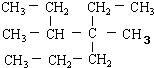 的名称为4,5-二甲基-4-乙基庚烷 的名称为4,5-二甲基-4-乙基庚烷 | |
| B. | 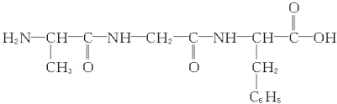 完全水解可以得到3种氨基酸 完全水解可以得到3种氨基酸 | |
| C. | 石油裂解和油脂皂化都是由高分子物质生成小分子物质的过程 | |
| D. | 化合物 的一氯代物有2种 的一氯代物有2种 |
3.下列说法不正确的是( )
| A. | 天然气的主要成分是甲烷 | |
| B. | 煤是由有机物和无机物组成的复杂的混合物 | |
| C. | 含C18以上烷烃的重油经裂化可以得到汽油 | |
| D. | 煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来 |
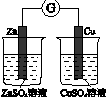
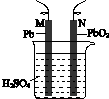
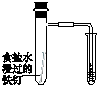
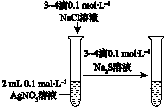
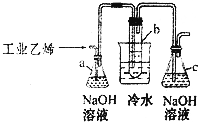 CH2Br-CH2Br可作汽油抗爆剂的添加剂,常温下是无色液体,温度2.18g•cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.试管b中装有液溴(表面覆盖少量水).工业用乙烯中含少量H2S气体.利用工业乙烯通过下列装置可制备少量CH2B-CH2Br
CH2Br-CH2Br可作汽油抗爆剂的添加剂,常温下是无色液体,温度2.18g•cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.试管b中装有液溴(表面覆盖少量水).工业用乙烯中含少量H2S气体.利用工业乙烯通过下列装置可制备少量CH2B-CH2Br