题目内容
【题目】2017年5月18日,中国国土资源部地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个海域试采可燃冰成功的国家,可燃冰即天然气水合物,甲烷含量占80%至99.9%。化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H1 =-36kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2 =+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,每生产lmolCO,转移电子的数目为__________。
(2)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1 =-90kJ·mol-1 K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2 K2
己知:CO(g)+H2O(g)= CO2(g)+H2(g) △H3 =-41.1kJ·mol-1 K3
H2O(l)=H2O(g) △H4 =+44.0kJ·mol-1 K4
则△H2=______ K2=_______ (用含K1、K3、K4的代数式表示)
(3)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g) ![]() CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)
①下列能说明该反应已达到平衡状态的是______________________。
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
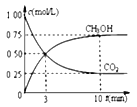
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为_____________(用含P的代数式表示,数值保留两位小数),若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则平衡______(填“正向“逆向“不”)移动。(已知:气体分压=气体总压×体积分数)
(4)甲醇可在电解银催化作用下制甲醛,从贵金属阳极泥中可提取“粗银”“粗银”(含Ag、Cu、Au)可用电解槽电解精炼,纯银作阴极,采用AgNO3和稀HNO3的混合液作电解液,阴极的主要电极反应式为_____。阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为_______。硝酸浓度不能过大,其原因是___________________________________________。
【答案】 6NA -93.0kJ/mol K1/K3K4 A、C 33.33/P2 正向 Ag++e-=Ag NO3-+4H++3e-=NO+2H2O 防止生成的银被硝酸溶解
【解析】(1)为维持热平衡,①×6+②相加可得7CH4(g) +3O2(g)+H2O(g)=7CO(g)+15H2(g) △H2 =0,反应中生成7molCO转移电子总数为42mol,所以生产lmolCO转移电子的数目为6NA;
(2)自上而下依次将这四个反应式分别标记为①②③④,则①-②-④即得己知反应③,故△H1-△H2-△H4 =△H3,所以△H2 =△H1-△H3-△H4= -92.9 kJ·mol-1;通过方程式的加减运算,可得平衡常数的乘除关系,所以K2= K1/K3K4;
(3) ①在恒温恒容密闭容器中,已知平衡CO2(g)十3H2(g) ![]() CH3OH(g)十H2O(g)是全气体反应,且气体分子数是减小的,所以A、根据M=m/n可知,当混合气体平均相对分子质量不变时,已达到平衡状态,A正确;B、由ρ=m/V可知,该混合气体的密度始终不变,故B错误;C、由于气体分子数即物质的量,反应前后减小,所以当容器内压强恒定不变时,已达平衡状态,C正确;D、根据速率之比等于计量系数之比,但方向相反,所以当V正(CO2)=3V逆(H2)时,不能说明反应已达平衡,正确的表达式为3 V正(CO2)=V逆(H2),则D错误;E、物质的量浓度保持不变,说明已达平衡,但浓度之比等于计量系数之比不能说明已达平衡,故E错误;F、单位时间内断裂3NA个H-H键是正向速率,同时形成2molH-O键也是正向速率,所以不能说明已达平衡,故F错误。正确的答案为AC。
CH3OH(g)十H2O(g)是全气体反应,且气体分子数是减小的,所以A、根据M=m/n可知,当混合气体平均相对分子质量不变时,已达到平衡状态,A正确;B、由ρ=m/V可知,该混合气体的密度始终不变,故B错误;C、由于气体分子数即物质的量,反应前后减小,所以当容器内压强恒定不变时,已达平衡状态,C正确;D、根据速率之比等于计量系数之比,但方向相反,所以当V正(CO2)=3V逆(H2)时,不能说明反应已达平衡,正确的表达式为3 V正(CO2)=V逆(H2),则D错误;E、物质的量浓度保持不变,说明已达平衡,但浓度之比等于计量系数之比不能说明已达平衡,故E错误;F、单位时间内断裂3NA个H-H键是正向速率,同时形成2molH-O键也是正向速率,所以不能说明已达平衡,故F错误。正确的答案为AC。
②由已知数据和图象所示数据可知,容器体积为1L,可列如下关系:
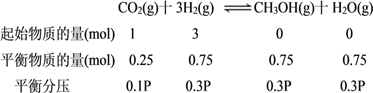
所以Kp= ![]() =33.33/P2 ;若此时再向容器内充入0.25mol CO2和0.25molCH3OH的混合气体,则Qp=
=33.33/P2 ;若此时再向容器内充入0.25mol CO2和0.25molCH3OH的混合气体,则Qp=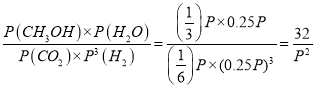 <
<![]() =Kp,所以平衡正向移动。
=Kp,所以平衡正向移动。
(4)金属银精练时,用纯银作阴极,用粗银作阳极,根据电解液中阳离子的性质可知,Ag+先放电,所以阴极上的主要电极反应为Ag++e-=Ag;但硝酸具有强氧化性,易得电子生成NO气体,遇空气迅速变为红棕色,电极反应为NO3-+4H++3e- =NO+2H2O;又硝酸能氧化银等不活泼金属,所以硝酸的浓度不能过大。

【题目】冬季是流感多发季节,最近我校许多学生得了流感,表现症状为发热头痛等,乙酰苯胺是磺胺类药物具有很好退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:
![]()
己知:①苯胺易被氧化:
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20℃) |
乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
苯胺 | -6℃ | 184.4℃ | 3.4 |
醋酸 | 16.6℃ | 118℃ | 易溶 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。

实验步骤如下:
步骤1:在50mL烧瓶中加入9mL(0.10mol)苯胺、15mL(0.27mol)冰醋酸及少许锌粉,依照上图装置组装仪器。
步骤2:控制温度计示数约105℃,小火加热回流1h。
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g。
请回答下列问题:
(1)步骤1中加入锌粉的作用是________________________________。
(2)步骤2加热可用_________________(填“水浴”或“油浴”)
(3)锥形瓶所接的蒸馏物是______________(填化学式)。实验这样设计的目的是__________________。
(4)步骤2中,控制温度计读数在105℃左右的原因_______________,得到的粗产品需进一步提纯,该提纯方法是________________________________________________________。
(5)纯净的乙酰苯胺为无色片状晶体,对无色片状晶体进行干燥,判断晶体干燥完全的实验方法是___________________________________________。
(6)请计算所得到乙酰苯胺的产率是_________________________________________________。
【题目】将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
① | 100 | 17.2 | 2.24 |
② | 200 | 8.00 | 4.48 |
③ | 400 | 0 | V |
下列说法正确的是( )
A.表中 V=7.84 L
B.原混合物粉末的质量为25.6 g
C.原混合物粉未中铁和铜的物质的量之比为2:3
D.实验3所得溶液中硝酸的物质的量浓度为0.875 molL﹣1