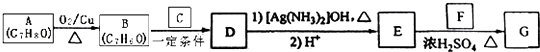��Ŀ����
����Ŀ�������й�ʵ���������ȷ����
ѡ�� | ʵ�鷽�� | ʵ��Ŀ�Ļ���� |
A | ��һƬ�������ھƾ������������� | ͨ�����������ۻ���������֤������ֻ�����������仯 |
B | �ò�����պȡ��ˮ�ε�pH��ֽ�ϣ��Աȱ���ɫ����ɫ | ͨ����ɫ�仯�ɲⶨ��ˮ��pH |
C | ���Ҵ��м�������Ũ�����Ʊ���ϩ����������������ֱ��ͨ������KMnO4��Һ�� | ͨ������KMnO4��ɫ��֤����ϩ�ܱ����Ը���������� |
D | ȡ������Һ���Թ��У�����NaOH��Һ����������ʪ���ɫʯ����ֽ������������� | ͨ����ֽ��ɫ����ɼ���ԭ��Һ���Ƿ���NH4+ |
A. A B. B C. C D. D
���𰸡�D
��������A.�������۵�������������ɵ���������Ĥ�������������ۻ������������ۻ������������ۻ��������䣬��A����B.��ˮ�еĴ��������Ư��ָʾ�������Բ�����pH��ֽ�ⶨ��ˮ��pH����B����C.�Ҵ�Ҳ���Ա����Ը��������Һ��������C����D. ![]() +
+ ![]() -
-![]() NH3��+ H2O��NH3��ʹ���ɫʯ����ֽ��������D��ȷ����ѡD��
NH3��+ H2O��NH3��ʹ���ɫʯ����ֽ��������D��ȷ����ѡD��

 ��ڽ��ȫ������ϵ�д�
��ڽ��ȫ������ϵ�д�����Ŀ�����������ж���ڣ������У����ѧ���������У�����֢״Ϊ����ͷʹ�ȣ����������ǻǰ���ҩ����кܺ�������ʹ���ã��ǽ���ʹ�õĽ�����ʹҩ���С����ȱ���֮�ơ����Ʊ�ԭ������:
![]()
��֪:�ٱ����ױ�������
�����������������ʹ���IJ��������������±�:
���� | �۵� | �е� | �ܽ��(20��) |
�������� | 114.3�� | 305�� | 0.46 |
���� | -6�� | 184.4�� | 3.4 |
���� | 16.6�� | 118�� | ���� |
ע:���η������������൱�ڶ����������ڷе���̫��Ļ����ķ��롣

ʵ�鲽������:
����1:��50mL��ƿ�м���9mL(0.10mol)������15mL(0.27mol)�����ἰ����п�ۣ�������ͼװ����װ������
����2:�����¶ȼ�ʾ��Լ105��,С����Ȼ���1h��
����3:���Ƚ���Ӧ����ﵹ��ʢ��100mL��ˮ���ձ��У���ȴ����ˣ�ϴ�ӣ��õ��ֲ�Ʒ��
����4:������3���ôֲ�Ʒ��һ���ᴿ�Ƶò�Ʒ����Ϊ10.8g��
��ش���������:
(1)����1�м���п�۵�������________________________________��
(2)����2���ȿ���_________________(�ˮԡ������ԡ��)
(3)��ƿ���ӵ���������______________(�ѧʽ)��ʵ��������Ƶ�Ŀ����__________________��
(4)����2�У������¶ȼƶ�����105�����ҵ�ԭ��_______________���õ��Ĵֲ�Ʒ���һ���ᴿ�����ᴿ������________________________________________________________��
(5)��������������Ϊ��ɫƬ״���壬����ɫƬ״������и���жϾ��������ȫ��ʵ�鷽����___________________________________________��
(6)��������õ����������IJ�����_________________________________________________��
����Ŀ����һ����ͭ������ĩƽ���ֳ����ȷݣ��ֱ���뵽ͬŨ�ȡ���ͬ�����ϡ�����У���ַ�Ӧ���ռ���NO����������ʣ������������� ���跴Ӧǰ����Һ��������䣬��������ѻ���Ϊ��״��ʱ���������
ʵ����ź� | ϡ��������/mL | ʣ����������/g | NO�����/L |
�� | 100 | 17.2 | 2.24 |
�� | 200 | 8.00 | 4.48 |
�� | 400 | 0 | V |
����˵����ȷ���ǣ�������
A.���� V=7.84 L
B.ԭ������ĩ������Ϊ25.6 g
C.ԭ������δ������ͭ�����ʵ���֮��Ϊ2��3
D.ʵ��3������Һ����������ʵ���Ũ��Ϊ0.875 molL��1