题目内容
【题目】复合氢化物可作为储氢和固体电解质材料,在能源与材料领域得到了广泛而深入的研究。
(1)复合氢化物升温加热可逐步分解放出氢气,理论上单位质量的下列复合氢化物其储氢能力由高到低的顺序是_______________(填标号)。
A.Mg(NH2)2 B.NaNH2 C.H3N-BH3 D.NaAlH4 E.Li3AlH6
(2)在Mg(NH2)2和NaNH2中均存在NH![]() ,NH
,NH![]() 的空间构型为____________,中心原子的杂化方式为___________。
的空间构型为____________,中心原子的杂化方式为___________。
(3)2019年Rahm利用元素价电子的结合能重新计算各元素的电负性,短周期主族元素的Rahm电负性数值如下表所示:
元素符号 | H | ||||||
Rahm电负性 | 13.6 | ||||||
元素符号 | Li | Be | B | C | N | O | F |
Rahm电负性 | 5.4 | 9.3 | 11.4 | 13.9 | 16.9 | 18.6 | 23.3 |
元素符号 | Na | Mg | Al | Si | P | S | Cl |
Rahm电负性 | 5.1 | 7.6 | 9.1 | 10.8 | 12.8 | 13.6 | 16.3 |
①写出基态B原子的价电子轨道表达式:______________________。
②通过上表可以推测Rahm电负性小于___________________的元素为金属元素。
③结合上表数据写出H3N-BH3与水反应生成一种盐和H2的化学方程式____________________。
(4)Li3AlH6晶体的晶胞参数为a=b=801.7pm、c=945.5pm,α=β=90°、γ=120°,结构如图所示:
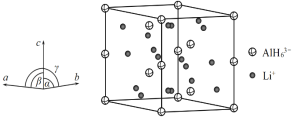
① 已知AlH![]() 的分数坐标为(0,0,0)、
的分数坐标为(0,0,0)、![]() 、
、![]() 、
、![]() 、
、![]() 和,
和,![]() ,晶胞中Li+的个数为____________。
,晶胞中Li+的个数为____________。
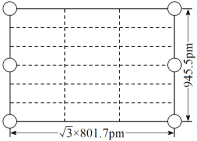
② 右图是上述Li3AlH6晶胞的某个截面,共含有10个AlH![]() ,其中6个已经画出(图中的O),请在图中用O将剩余的AlH
,其中6个已经画出(图中的O),请在图中用O将剩余的AlH![]() 画出_________________。
画出_________________。
③ 此晶体的密度为____________________________g·cm-3(列出计算式,已知阿伏加德罗常数约为6.02×1023mol-1)。
【答案】B V形 sp3 ![]() 10.0(9.4~10.7之间任意一个数均可) H3N-BH3+2H2O=NH4BO2+3H2 18
10.0(9.4~10.7之间任意一个数均可) H3N-BH3+2H2O=NH4BO2+3H2 18 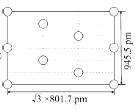 或
或
![]()
【解析】
(1)复合氢化物中氢元素的质量分数即为单位质量复合氢化物的储氢能力,Mg(NH2)2中氢的质量分数为![]() ,NaNH2中H%为
,NaNH2中H%为![]() ,H3N-BH3中H%为
,H3N-BH3中H%为![]() 、NaAlH4中H%为
、NaAlH4中H%为![]() 、⑤Li3AlH6中H%为
、⑤Li3AlH6中H%为![]() ,所以储氢能力最低的是B;
,所以储氢能力最低的是B;
(2) NH![]() 的价层电子数为
的价层电子数为![]() ,根据VSEPR理论,NH
,根据VSEPR理论,NH![]() 的理论构型为正四面体,因含两对孤对电子,所以NH2-的空间构型为V形,因价层电子对数为4,所以中心原子N的杂化方式为sp3杂化;
的理论构型为正四面体,因含两对孤对电子,所以NH2-的空间构型为V形,因价层电子对数为4,所以中心原子N的杂化方式为sp3杂化;
(3)①硼是第5号元素,在元素周期表中位于第二周期第ⅢA族、p区,其基态原子核外电子排布式为1s22s22p1,价电子排布式为2s22p1,价电子轨道表达式为![]() ;
;
②表中金属元素电负性最大的为9.3,非金属元素电负性最小的为10.8,可以判断电负性小于10.0(9.4~10.7之间任意一个数均可)的元素为金属元素;
③据表可知H的电负性大于B,所以H3N-BH3中氮原子上的氢原子带正电荷,硼原子上的氢原子带负电荷,所以H3N-BH3与水反应时,-BH3中的氢原子与水发生归中反应生成氢气,-BH3转化为B(OH)![]() (变可简写为BO
(变可简写为BO![]() ),所以反应的化学方程式为:H3N-BH3+2H2O=NH4BO2+3H2;
),所以反应的化学方程式为:H3N-BH3+2H2O=NH4BO2+3H2;
(4) ①根据AlH![]() 的分数坐标可以判断其在晶胞中的位置:8个在顶点、4个在侧棱棱心、4个在晶胞体内,由分摊法可得一个晶胞中含有6个AlH
的分数坐标可以判断其在晶胞中的位置:8个在顶点、4个在侧棱棱心、4个在晶胞体内,由分摊法可得一个晶胞中含有6个AlH![]() ,根据晶体的化学式可知晶胞中Li+与AlH
,根据晶体的化学式可知晶胞中Li+与AlH![]() 的个数比为3:1,所以一个晶胞中所含有Li+的个数为18;
的个数比为3:1,所以一个晶胞中所含有Li+的个数为18;
②由截面的边长(![]() ×801.7pm和945.5pm)可知这是过晶胞底面和顶面对角线的截面,题目表明了这个截面中一共含有10个AlH
×801.7pm和945.5pm)可知这是过晶胞底面和顶面对角线的截面,题目表明了这个截面中一共含有10个AlH![]() ,又画出4个位于顶点、2个位于棱心的AlH
,又画出4个位于顶点、2个位于棱心的AlH![]() ,所以需要画出的是4个位于晶.胞体内的AlH
,所以需要画出的是4个位于晶.胞体内的AlH![]() ,结合AlH
,结合AlH![]() 的分数坐标,即可将缺失的AlH
的分数坐标,即可将缺失的AlH![]() 补充完整,得到下图:
补充完整,得到下图: 或
或
③一个晶胞中含有6个Li3AlH6,则晶胞的质量m=![]() g,晶胞底面为菱形,根据几何知识可知晶胞的体积V=801.72×945.5×sin60°pm3,所以该晶体的密度为
g,晶胞底面为菱形,根据几何知识可知晶胞的体积V=801.72×945.5×sin60°pm3,所以该晶体的密度为![]() 。
。

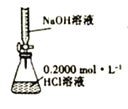
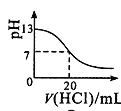
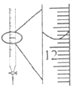
【题目】下列实验方案中,不能达到相应实验目的的是
选项 | A | B | C | D |
实验方案 |
|
|
|
|
目的 | 研究温度对化学平衡的影响 | 验证锌与硫酸铜反应过程中有电子转移 | 证明溶解度:AgCl>Ag2S | 比较不同催化剂对化学反应速率的影响 |
A.AB.BC.CD.D