题目内容
【题目】【加试题】烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9 kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2 kJ·mol-1
SO2(g)+O3(g)![]() SO3(g)+O2(g) △H=-241.6 kJ·mol-1
SO3(g)+O2(g) △H=-241.6 kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的 △H=_ ______ kJ·mol-1。
(2)臭氧脱硝反应2NO2(g)+O3(g)![]() N2O5(g)+O2(g)能自发进行。在温度为T1K时,向体积为2L的恒容密闭容器中充入1 mol O3和2 mol NO2,发生上述反应,经25分钟反应达平衡,测得平衡时N2O5(g)的浓度为0.25 mol·L-1。
N2O5(g)+O2(g)能自发进行。在温度为T1K时,向体积为2L的恒容密闭容器中充入1 mol O3和2 mol NO2,发生上述反应,经25分钟反应达平衡,测得平衡时N2O5(g)的浓度为0.25 mol·L-1。
①判断该反应的△S__ _____0,△H_ ______0(填>、<或=)。
②在温度为T1K时该反应的平衡常数K= 。
③下列说法正确的是 。
A.从反应开始到达平衡,NO2的平均反应速率v(NO2)=0.04mol·L-1·min-1
B.T1K时,若起始时向容器中充入1 mol O3、2 mol NO2、1 mol O2和1 mol N2O5气体,则反应达到平衡前v(正) <v(逆)
C.若改变反应温度为T2K,测得平衡时NO2的浓度为0.60 mol·L-1,则T2>T1
D.T1K时反应达平衡时容器的体积为2L,若维持T1K压缩容器使NO2转化率为60%,则此时容器的体积约为0.71L
④若维持其他条件不变,仅改变温度为T2K时,经15分钟反应达平衡,测得平衡时N2O5(g)的浓度为0.20 mol·L-1。画出在T2K下从0到25分钟c(NO2)随时间变化图。

【答案】(1)-317.3(2分)(2)①< (1分) < (1分) ② 1(2分) ③CD(2分)
④ 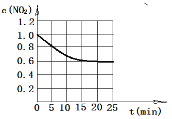 (2分)
(2分)
【解析】
试题分析:(1)已知:①NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9 kJ·mol-1
②NO(g)+1/2O2(g)=NO2(g) △H=-58.2 kJ·mol-1
根据盖斯定律可知①+②×2即得到反应3NO(g)+O3(g)=3NO2(g)的△H=-317.3kJ·mol-1。
(2)臭氧脱硝反应2NO2(g)+O3(g)![]() N2O5(g)+O2(g)能自发进行。在温度为T1K时,向体积为2L的恒容密闭容器中充入1 mol O3和2 mol NO2,发生上述反应,经25分钟反应达平衡,测得平衡时N2O5(g)的浓度为0.25 mol·L-1。
N2O5(g)+O2(g)能自发进行。在温度为T1K时,向体积为2L的恒容密闭容器中充入1 mol O3和2 mol NO2,发生上述反应,经25分钟反应达平衡,测得平衡时N2O5(g)的浓度为0.25 mol·L-1。
①正反应是体积减小的可逆反应,则该反应的△S<0。由于该反应能自发进行,则根据△G=△H-T·△S可知该反应的△H<0。
② 2NO2(g)+O3(g)![]() N2O5(g)+O2(g)
N2O5(g)+O2(g)
起始浓度(mol/L) 1 0.5 0 0
转化浓度(mol/L) 0.5 0.25 0.25 0.25
平衡浓度(mol/L) 0.5 0.25 0.25 0.25
则在温度为T1K时该反应的平衡常数K=![]() 。
。
③A.从反应开始到达平衡,NO2的平均反应速率v(NO2)=0.5mol/L÷25min=0.02mol·L-1·min-1,A错误;B.T1K时,若起始时向容器中充入1 mol O3、2 mol NO2、1 mol O2和1 mol N2O5气体,则此时浓度熵=![]() <1,因此反应达到平衡前v(正)>v(逆),B错误;C.若改变反应温度为T2K,测得平衡时NO2的浓度为0.60 mol·L-1,这说明平衡向逆反应方向进行,由于正反应是放热反应,则T2>T1,C正确;D.
<1,因此反应达到平衡前v(正)>v(逆),B错误;C.若改变反应温度为T2K,测得平衡时NO2的浓度为0.60 mol·L-1,这说明平衡向逆反应方向进行,由于正反应是放热反应,则T2>T1,C正确;D.
2NO2(g)+O3(g)![]() N2O5(g)+O2(g)
N2O5(g)+O2(g)
起始浓度(mol) 2 1 0 0
转化浓度(mol) 1.2 0.6 0.6 0.6
平衡浓度(mol) 0.8 0.4 0.6 0.6
则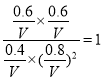
解得V=0.71L,D正确,答案选CD。
④升高温度反应速率加快,到达平衡的时间减少,经15分钟反应达平衡,测得平衡时N2O5(g)的浓度为0.20 mol·L-1,因此消耗二氧化氮浓度是0.4mol/L,剩余二氧化氮浓度是0.6mol/L,则图像可表示为 。
。

 阅读快车系列答案
阅读快车系列答案【题目】下列物质既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2 ②![]() ③
③![]()
④![]() ⑤CH
⑤CH![]() C CH3⑥CH3(CH2)4CH3
C CH3⑥CH3(CH2)4CH3
A. ①②③④ B. ③④⑤ C. ①②④⑥ D. ①②⑤
【题目】(1)用正确的序号填空: ①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
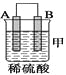
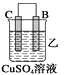
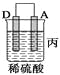
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 | C的质 | A上有气 |
根据实验现象回答下列问题:
①装置甲中作正极的是________ (填“A”或“B”) 。
②装置乙溶液中Cu2+向_______极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于______(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是_______。