题目内容
【题目】下列物质既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2 ②![]() ③
③![]()
④![]() ⑤CH
⑤CH![]() C CH3⑥CH3(CH2)4CH3
C CH3⑥CH3(CH2)4CH3
A. ①②③④ B. ③④⑤ C. ①②④⑥ D. ①②⑤
【答案】D
【解析】试题分析:①SO2具有较强的还原性,既能被溴水氧化,也能被酸性KMnO4溶液氧化,故①正确;②![]() 分子中含有碳碳双键,既能与溴水发生加成反应,也能被酸性KMnO4溶液氧化,故②正确;③
分子中含有碳碳双键,既能与溴水发生加成反应,也能被酸性KMnO4溶液氧化,故②正确;③![]() 中不存在碳碳双键,与溴水和酸性高锰酸钾溶液均不反应,故③错误;④
中不存在碳碳双键,与溴水和酸性高锰酸钾溶液均不反应,故③错误;④![]() 能被酸性高锰酸钾溶液氧化,但不与溴水反应,故④错误;⑤CH
能被酸性高锰酸钾溶液氧化,但不与溴水反应,故④错误;⑤CH![]() C CH3分子中含有碳碳三键,既能与溴水发生加成反应,也能被酸性KMnO4溶液氧化,故⑤正确;⑥CH3(CH2)4CH3属于烷烃,性质稳定,与溴水和酸性高锰酸钾溶液均不发生反应,故⑥错误。综上所述①②⑤正确,故选D。
C CH3分子中含有碳碳三键,既能与溴水发生加成反应,也能被酸性KMnO4溶液氧化,故⑤正确;⑥CH3(CH2)4CH3属于烷烃,性质稳定,与溴水和酸性高锰酸钾溶液均不发生反应,故⑥错误。综上所述①②⑤正确,故选D。

【题目】[化学——选修3:物质结构与性质]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。

(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________________,微粒之间存在的作用力是_____________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为______。
,0)。则D原子的坐标参数为______。
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为__________g·cm-3(列出计算式即可)。
【题目】下表为元素周期表的一部分:
族 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
I. 请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)画出元素②的离子结构示意图______________。
(2
(3)元素④和⑥形成的化合物的电子式:____________________。
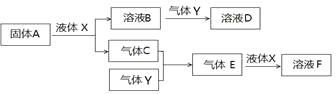
II. 由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答:
(4)写出固体A与液体X反应的离子方程式 。
(5)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,写出过量的Y与B
溶液反应的离子方程式__________________________________________________
(6)若气体C与Y在恒容绝热的条件下反应,下列哪些说法说明该反应达到平衡状态:_______
A. 温度不变
B. 2v正(C)=v逆(Y)
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变


