题目内容
2.(1)下列装置属于原电池的是⑤;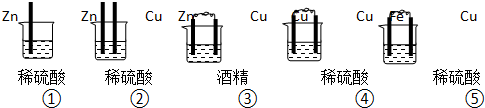
(2)在选出的原电池中,Fe 是负极,发生氧化 反应,Cu 是正极,该极的现象有气泡产生;
(3)此原电池反应的化学方程式为Fe+H2SO4=FeSO4+H2↑.
分析 (1)原电池的构成条件:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发进行的氧化还原反应;
(2)该原电池中,铁易失电子作负极,铜作正极,正极上氢离子得电子发生还原反应;
(3)该原电池反应与铁与稀硫酸反应相同.
解答 解:(1)①中没有两个活泼性不同的电极,所以不能构成原电池,故错误;
②没有构成闭合回路,所以不能构成原电池,故错误;
③酒精为非电解质溶液,所以不能构成原电池,故错误;
④电极材料相同,所以不能构成原电池,故错误;
⑤符合原电池的构成条件,所以能构成原电池,故正确;
故选⑤;
(2)该装置中,铁易失电子而作负极,铜作正极,负极上铁失电子生成亚铁离子发生氧化反应,正极上氢离子得电子发生还原反应而生成氢气,所以有气泡生成,
故答案为:Fe;氧化;Cu;有气泡产生;
(3)该原电池中,铁失电子生成亚铁离子,正极上氢离子得电子生成氢气,所以电池反应式为:Fe+H2SO4=FeSO4+H2↑,故答案为:Fe+H2SO4=FeSO4+H2↑.
点评 本题考查了原电池的构成条件、原电池原理,明确原电池的构成条件、原电池原理内涵是解本题关键,正极电极上发生的电极反应来分析解答,题目难度不大.

练习册系列答案
相关题目
12.我们熟知的一些化合物的应用错误的是( )
| A. | MgO用于冶炼金属镁 | B. | NaCl用于制纯碱 | ||
| C. | Cu(OH)2用于检验糖尿病 | D. | FeCl3用于净水 |
13.正丁醛经催化加氢可制备1-丁醇.为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
粗品$→_{操作1}^{饱和NaHSO3溶液}$滤液$→_{萃取}^{乙醛}$操作2有机层$→_{操作3}^{固体干燥剂}$1-丁醇乙醚(操作4)纯品
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃.则操作1~4分别是( )
粗品$→_{操作1}^{饱和NaHSO3溶液}$滤液$→_{萃取}^{乙醛}$操作2有机层$→_{操作3}^{固体干燥剂}$1-丁醇乙醚(操作4)纯品
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃.则操作1~4分别是( )
| A. | 萃取、过滤、蒸馏、蒸馏 | B. | 过滤、分液、蒸馏、萃取 | ||
| C. | 过滤、蒸馏、过滤、蒸馏 | D. | 过滤、分液、过滤、蒸馏 |
10.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 | |
| B. | 乙烯和聚乙烯二者都能使溴的四氯化碳溶液褪色 | |
| C. | 化合物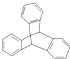 是苯的同系物 是苯的同系物 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
17.最新报道,科学家又发现了某元素的一种原子,它的原子核内有161个中子,质量数为272.该元素的原子序数为( )
| A. | 111 | B. | 161 | C. | 272 | D. | 433 |
7.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L乙醇完全燃烧所耗的氧气分子数为3NA | |
| B. | 0.5molC3H8分子中所含C-H共价键数为2NA | |
| C. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| D. | 1mol碳正离子CH3+所含的电子数为6NA |
14.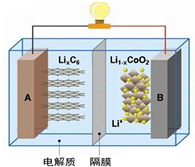 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 充电时Li+从右边流向左边 | |
| B. | 放电时,正极锂的化合价未发生改变 | |
| C. | 充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
11.共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:①Na2O2;②SiO2;③石墨;④金刚石;⑤CaH2;⑥白磷(P4),其中含有两种结合力的组合是( )
| A. | ①③⑤⑥ | B. | ①③⑥ | C. | ②④⑥ | D. | ①②③⑥ |
12.现有CH3COOH和两种链状单烯烃的混合物,若其中氧的质量分数为a,则碳的质量分数是( )
| A. | $\frac{1-a}{7}$ | B. | $\frac{3}{4}$a | C. | $\frac{6}{7}$(1-a) | D. | $\frac{12}{13}$(1-a) |