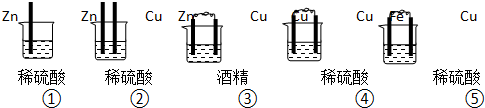
题目内容
7.用NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 标准状况下,22.4L乙醇完全燃烧所耗的氧气分子数为3NA | |
| B. | 0.5molC3H8分子中所含C-H共价键数为2NA | |
| C. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| D. | 1mol碳正离子CH3+所含的电子数为6NA |
分析 A、标准状况乙醇不是气体;
B、烷烃是饱和烷烃所含C-H键位所含氢原子数;
C、物质的量n=$\frac{m}{M}$,乙烯和丙烯最简式相同为CH2,只需计算2.8gCH2中所含碳原子数;
D、1个CH3+中含有8个电子.
解答 解:A、标准状况乙醇不是气体,22.4L乙醇物质的量不是1mol,故A错误;
B、烷烃是饱和烷烃所含C-H键位所含氢原子数,0.5molC3H8分子中所含C-H共价键数为4NA,故B错误;
C、乙烯和丙烯最简式相同为CH2,2.8gCH2中所含碳原子的物质的量n=$\frac{m}{M}$=$\frac{2.8g}{14g/mol}$=0.2mol,含碳原子数0.2NA,故C正确;
D、1个CH3+中含有8个电子,1mol碳正离子CH3+所含的电子数为8NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积,物质结构和微粒物质的量的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.在化学能与电能的转化中,下列叙述正确的是( )
| A. | 镀锌铁皮在食盐水中发生析氢腐蚀 | |
| B. | 电解池的阴极材料一定比阳极材料活泼 | |
| C. | 将铁器与电源正极相连,可在其表面镀锌 | |
| D. | 原电池的负极和电解池的阳极均发生氧化反应 |
12.下列说法正确的是( )
| A. | 除去硬脂酸钠溶液中的甘油方法是:往溶液中加入饱和食盐水,分液 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. | 自来水厂常用某些含铝或铁的化合物作净水剂,是由于这些物质具有杀菌消毒作用 | |
| D. | 室温下,浓度均为0.1mol•L-1Na2S2O3和H2SO4溶液,分别取5mL与10mL混合,10mL与10mL混合,可验证Na2S2O3浓度对反应速率的影响 |
19.某溶液能与铁片作用产生H2,则该溶液中一定可以大量共存的离子组是( )
| A. | NO3-、K+、Cl-、I- | B. | NH4+、Na+、SO42-、Ba2+ | ||
| C. | Na+、SO42-、HCO3-、K+ | D. | Mg2+、Cl-、SO42-、Na+ |
16.下列物质不属于同素异形体的是( )
| A. | 金刚石和石墨 | B. | 水晶和石英 | C. | 红磷和白磷 | D. | C60和金刚石 |
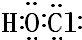 .
.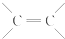 结构的有机物可被高锰酸钾溶液氧化成二元醇,如:CH2═CH2 $\stackrel{KMnO_{4}溶液}{→}$HOCH2CH2OH,现以甲基丙烯(
结构的有机物可被高锰酸钾溶液氧化成二元醇,如:CH2═CH2 $\stackrel{KMnO_{4}溶液}{→}$HOCH2CH2OH,现以甲基丙烯(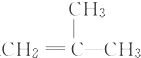 )为原料合成环状化合物F和高分子化合物E和G.
)为原料合成环状化合物F和高分子化合物E和G.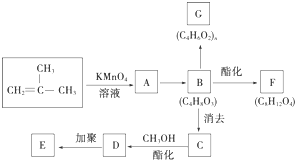
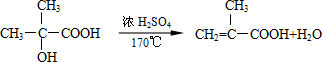 B→G的反应类型:缩聚,G的结构简式:
B→G的反应类型:缩聚,G的结构简式: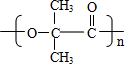 .
.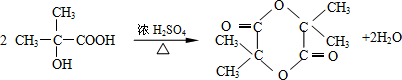 ,两分子B之间发生酯化反应除生成酯F外,还可能生成另外一种酯,该酯的结构简式为
,两分子B之间发生酯化反应除生成酯F外,还可能生成另外一种酯,该酯的结构简式为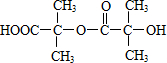 .
.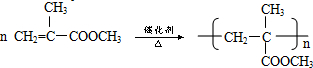 .
.