题目内容
【题目】碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)基态碳原子核外电子有__种空间运动状态,其价电子排布图为__.
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为__,其碳原子杂化轨道类型为_____杂化.
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?。 ______________
(4)碳的一种同素异形体﹣﹣C60,又名足球烯,是一种高度对称的球碳分子.立方烷(分子式:C8H8结构是立方体:![]() 是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间八面体空隙中.则该复合型分子晶体的组成用二者的分子式可表示为__。
是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间八面体空隙中.则该复合型分子晶体的组成用二者的分子式可表示为__。

(5)碳的另一种同素异形体——石墨,其晶体结构如图所示,则石墨晶胞含碳原子个数为__个.已知石墨的密度为ρg·cm﹣3,C﹣C键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距为__cm.
(6)金刚石和石墨的物理性质差异很大,其中:熔点较高的是___________,试从结构分析___________;硬度大的是___________,其结构原因是___________。
【答案】 6 ![]() 平面三角形 sp2 碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,金属氧化物的晶格能越大,对应的碳酸盐就越容易分解 C8H8·C60 4
平面三角形 sp2 碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,金属氧化物的晶格能越大,对应的碳酸盐就越容易分解 C8H8·C60 4 ![]() 石墨 石墨为混合型晶体,金刚石为原子晶体,二者熔点均取决于碳碳共价键,前者键长短,则熔点高 金刚石 石墨硬度取决于分子间作用力,而金刚石取决于碳碳共价键
石墨 石墨为混合型晶体,金刚石为原子晶体,二者熔点均取决于碳碳共价键,前者键长短,则熔点高 金刚石 石墨硬度取决于分子间作用力,而金刚石取决于碳碳共价键
【解析】(1)碳原子核外有6个电子,原子核外没有运动状态相同的电子,因此有6种运动状态不同的电子,碳原子价电子排布式为2s22p2,根据泡利原理与洪特规,价电子排布图为![]() ;(2)光气的分子式为COCl2,其分子中C原子形成3个σ键,没有孤对电子,空间结构为平面三角形,杂化轨道数目为3,C原子采取sp2杂化;(3)碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,金属氧化物的晶格能越大,对应的碳酸盐就越容易分解,因此随着阳离子半径的增大,碳酸盐的分解温度逐步升高;(4)晶胞中C60数目为8×1/8+6×1/2=4,立方烷分子填充在原C60晶体的分子间空隙中,晶胞中立方烷数目为4,则化学式为C8H8·C60。(5)由图可知石墨的晶胞结构为
;(2)光气的分子式为COCl2,其分子中C原子形成3个σ键,没有孤对电子,空间结构为平面三角形,杂化轨道数目为3,C原子采取sp2杂化;(3)碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,金属氧化物的晶格能越大,对应的碳酸盐就越容易分解,因此随着阳离子半径的增大,碳酸盐的分解温度逐步升高;(4)晶胞中C60数目为8×1/8+6×1/2=4,立方烷分子填充在原C60晶体的分子间空隙中,晶胞中立方烷数目为4,则化学式为C8H8·C60。(5)由图可知石墨的晶胞结构为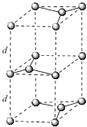 ,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为
,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为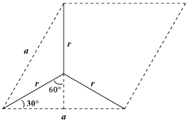 ,则a/2=r×sin60°,可得a=
,则a/2=r×sin60°,可得a=![]() ,则底面面积为(
,则底面面积为(![]() )2×Sin60°,晶胞中C原子数目为1+2×1/2+8×1/8+4×1/4=4,晶胞质量为4×12/NAg,则:ρg·cm-3=(4×12/NA)g÷[(
)2×Sin60°,晶胞中C原子数目为1+2×1/2+8×1/8+4×1/4=4,晶胞质量为4×12/NAg,则:ρg·cm-3=(4×12/NA)g÷[(![]() )2×Sin60°×2d]cm3,整理可得
)2×Sin60°×2d]cm3,整理可得![]() cm。(6)石墨为混合型晶体,金刚石为原子晶体,二者熔点均取决于碳碳共价键,前者键长短,则熔点高。石墨硬度取决于分子间作用力,而金刚石取决于碳碳共价键,所以硬度大的是金刚石。
cm。(6)石墨为混合型晶体,金刚石为原子晶体,二者熔点均取决于碳碳共价键,前者键长短,则熔点高。石墨硬度取决于分子间作用力,而金刚石取决于碳碳共价键,所以硬度大的是金刚石。

【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如图所示:
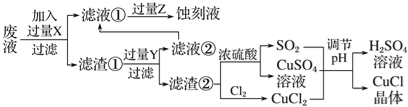
根据以上信息回答下列问题:
(1)写出生产过程中X________;Y________(填化学式)。
(2)析出的CuCl晶体不用水而用无水乙醇洗涤的目的是________________________;生产过程中调节溶液的pH不能过大的原因是________________________。
(3)写出生成CuCl的化学方程式:__________________________________。
(4)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是_________________。
(5)已知:常温下Ksp(CuCl)=1.6×10-7,Ksp(CuI)=1.2×10-12,现向CuCl饱和溶液中加入NaI固体至c(I-)=0.1mol/L,此时溶液中c(Cu+)/c(Cl-)=________。
(6)氯化亚铜的定量分析
①称取样品0.25 g置于已放入10 mL过量的FeCl3溶液的锥形瓶中,不断摇动。
②待样品溶解后,加水50 mL,邻菲罗啉指示剂2滴。
③立即用0.10 mol·L-1硫酸铈标准溶液滴定至终点,同时做空白实验一次。
已知:
CuCl+FeCl3===CuCl2+FeCl2;Fe2++Ce4+===Fe3++Ce3+。
如此再重复2次测得:
1 | 2 | 3 | |
空白实验消耗硫酸铈 标准溶液的体积/mL | 0.75 | 0.50 | 0.80 |
0.25 g样品消耗硫酸铈 标准溶液的体积/mL | 24.65 | 25.75 | 24.90 |
④数据处理:计算得CuCl的纯度为_________(平行实验结果相差不能超过0.3%)。