题目内容
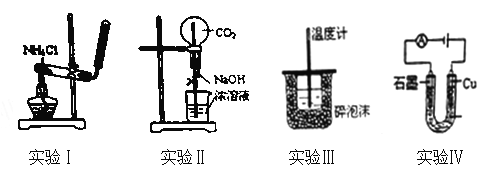
【题目】Ⅰ.下列气体的制备和性质实验中,由现象得出的结论正确的是________
选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
B | 浓盐酸、浓硫酸 | 蓝色石蕊试纸 | 变红 | HCl为酸性气体 |
C | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
D | 浓盐酸、二氧化锰 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
Ⅱ.CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。完成下列计算:
(1)CO2通入氨水生成NH4HCO3, NH4HCO3很容易分解。 2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00LNaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为__________________(填浓度范围)。
(3)CO2和 KO2 有下列反应:4KO2+2CO2=2K2CO3+3O2
4KO2+4CO2+2H2O=4K2HCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的物质的量应该是______________。
【答案】 ABD 89.6 1.2mol/L≤c≤2.4mol/L 3mol
【解析】(1)碳酸氢铵分解的化学方程式为:NH4HCO3![]() H2O+NH3↑+CO2↑,从方程式可以看出,分解产物经干燥后,所得气体为NH3和CO2,且n(NH3)+n(CO2)=2n(NH4HCO3)=2×2.00mol=4.00mol,则V(混合气体)=4.00mol×22.4L/mol=89.6L,即分解产物经干燥后的体积为89.6L。(2)根据题意要求,2.40 molCO2被完全吸收,NaOH也完全反应,则反应的产物可能是Na2CO3(此时NaOH的浓度最大)或NaHCO3(此时NaOH的浓度最小)或Na2CO3和NaHCO3的混合物。用极值思想分析两个特殊情况:①CO2+NaOH=NaHCO3,n(NaOH)= n(CO2)=2.40mol,则c(NaOH)=
H2O+NH3↑+CO2↑,从方程式可以看出,分解产物经干燥后,所得气体为NH3和CO2,且n(NH3)+n(CO2)=2n(NH4HCO3)=2×2.00mol=4.00mol,则V(混合气体)=4.00mol×22.4L/mol=89.6L,即分解产物经干燥后的体积为89.6L。(2)根据题意要求,2.40 molCO2被完全吸收,NaOH也完全反应,则反应的产物可能是Na2CO3(此时NaOH的浓度最大)或NaHCO3(此时NaOH的浓度最小)或Na2CO3和NaHCO3的混合物。用极值思想分析两个特殊情况:①CO2+NaOH=NaHCO3,n(NaOH)= n(CO2)=2.40mol,则c(NaOH)= ![]() =1.20mol/L;②CO2+2NaOH=Na2CO3+H2O,n(NaOH)=2n(CO2)=4.80mol,则c(NaOH)=
=1.20mol/L;②CO2+2NaOH=Na2CO3+H2O,n(NaOH)=2n(CO2)=4.80mol,则c(NaOH)=![]() =2.40mol/L;综合①、②可知,NaOH溶液的浓度应该为1.20mol/L≤c(NaOH)≤2.40mol/L。(3)方法一:依题意,9 mol CO2在密封舱内和KO2反应后生成9 mol O2,即n(CO2)∶n(O2)=1∶1,通过观察题给两个方程式可知,当把两个方程式相加时正好符合题目要求:8KO2+6CO2+2H2O=2K2CO3+4KHCO3+6O2,所以有n(H2O)=
=2.40mol/L;综合①、②可知,NaOH溶液的浓度应该为1.20mol/L≤c(NaOH)≤2.40mol/L。(3)方法一:依题意,9 mol CO2在密封舱内和KO2反应后生成9 mol O2,即n(CO2)∶n(O2)=1∶1,通过观察题给两个方程式可知,当把两个方程式相加时正好符合题目要求:8KO2+6CO2+2H2O=2K2CO3+4KHCO3+6O2,所以有n(H2O)=![]() n(CO2)=
n(CO2)=![]() ×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol。方法二:设反应前密封舱内H2O的物质的量为n
×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol。方法二:设反应前密封舱内H2O的物质的量为n
4KO2 + 4CO2 + 2H2O=4KHCO3 + 3O2
2n 1.5n
4KO2 + 2CO2=2K2CO3 + 3O2
9-2n 1.5(9-2n)
根据题意生成氧气9mol,所以有1.5n+ 1.5(9-2n)=9mol,解得n=3mol,即反应前密封舱内
H2O的物质的量为3mol。