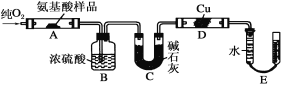
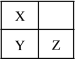题目内容
【题目】分析如图所示的四个原电池装置,其中结论正确的是

A. ①②中Mg作为负极,③④中Fe作为负极
B. ②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作为负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作为正极,电极反应式为2H++2e-===H2↑
【答案】B
【解析】试题分析:A.②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,③中金属铁在常温下遇浓硝酸钝化,不能形成原电池,故A错误;B.②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,Mg作为正极,电极反应式为6H2O+6e-═6OH-+3H2↑,故B正确;C.金属铁在常温下遇浓硝酸钝化,金属铜可以和浓硝酸之间反应,从而形成原电池,金属铜是负极,Cu-2e-═Cu2+,故C错误;D.铁、铜、氯化钠构成的原电池中,金属铁为负极,金属铜为正极,铁发生的是吸氧腐蚀,正极上是氧气得电子的过程,故D错误;故选B。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】Ⅰ.下列气体的制备和性质实验中,由现象得出的结论正确的是________
选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
B | 浓盐酸、浓硫酸 | 蓝色石蕊试纸 | 变红 | HCl为酸性气体 |
C | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
D | 浓盐酸、二氧化锰 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
Ⅱ.CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。完成下列计算:
(1)CO2通入氨水生成NH4HCO3, NH4HCO3很容易分解。 2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00LNaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为__________________(填浓度范围)。
(3)CO2和 KO2 有下列反应:4KO2+2CO2=2K2CO3+3O2
4KO2+4CO2+2H2O=4K2HCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的物质的量应该是______________。