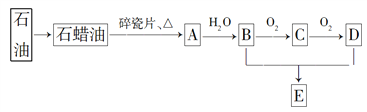
题目内容
【题目】消除SO2、NOx对大气造成的污染具有重要现实意义。
(1)将一定量的空气样品用蒸馏水溶解制成待测试样(忽略OH-)。常温下测得该试样的组成及其浓度如下表:
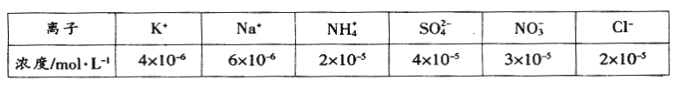
根据表中数据判断该试样的pH=____________。
(2)为减少SO2的排放,可将煤转化为清洁气体燃料,或将含SO2的烟气洗涤。
①已知:H2(g)+![]() O2(g)=H2O(g) △H=-241.8 kJ·mol-1
O2(g)=H2O(g) △H=-241.8 kJ·mol-1
C(s)+![]() O2(g)=CO(g) △H=-110.5 kJ·mol-1
O2(g)=CO(g) △H=-110.5 kJ·mol-1
写出焦炭与水蒸汽反应的热化学方程式____________。
②下列可作为洗涤含SO2烟气的洗涤剂是_________(填序号)。
A.浓氨水 B.碳酸氢钠饱和溶液
C.FeCl2饱和溶液 D.酸性CaCl2饱和溶液
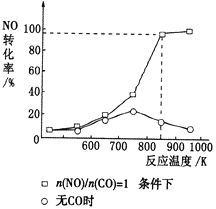
(3)实验室中研究有无CO对NO的有效消除程度,测得NO的转化率随温度的变化曲线如图所示。当无CO时,温度超过750K,发现NO的分解率降低,其可能的原因是________。当有CO且n(CO)/n(NO)=1时,为更好地除去NO,应控制的最佳温度为________K左右。
(4)用活性炭可处理大气污染物NO。在 5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
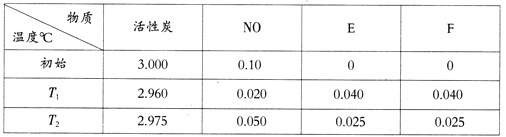
①写出NO与活性炭反应的化学方程式____________;
②若T1<T2,则该反应的△H________0(填“>”、“<”或“=”);
③上述反应T1℃时达到化学平衡后再通入0.1 mol NO气体,则达到新化学平衡时NO的转化率为________。
【答案】 4 C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol AB NO的分解反应是放热反应,升高温度,化学平衡向逆反应方向移动 850 C+2NO![]() CO2+N2 < 80%
CO2+N2 < 80%
【解析】(1)溶液中电荷守恒:c(K+)+c(NH4+)+c(Na+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-),4×10-6mol/L+2×10-5mol/L+6×10-6mol/L+c(H+)=2×4×10-5mol/L+3×10-5mol/L+2×10-5mol/L,得c(H+)=1×10-4molL-1,pH=-logc(H+)=4故答案为:4。
(2)已知:①H2(g)+ ![]() O2(g)═H2O(g);△H=-241.81kJmol-1,②C(s)+
O2(g)═H2O(g);△H=-241.81kJmol-1,②C(s)+![]() O2(g)═CO(g);△H=-110.51kJmol-1,利用盖斯定律,将②-①可得:C(s)+H2O(g)=CO(g)+H2(g),△H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,所以焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.30kJmol-1,故答案为:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.30kJmol-1;
O2(g)═CO(g);△H=-110.51kJmol-1,利用盖斯定律,将②-①可得:C(s)+H2O(g)=CO(g)+H2(g),△H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,所以焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.30kJmol-1,故答案为:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.30kJmol-1;
②A. 二氧化硫是酸性氧化物所以具有酸性氧化物的通性能够与浓氨水反应,可以用浓氨水吸收二氧化硫,故A正确;B. 二氧化硫水溶液是亚硫酸所以也能够与碳酸氢钠饱和溶液反应,生成二氧化碳气体,可以用碳酸氢钠溶液做洗涤剂,故B正确;C. 二氧化硫对应的酸是亚硫酸,酸性比盐酸酸性弱,所以二氧化硫与氯化亚铁不反应,故C错误;D. 二氧化硫与氯化钙溶液不反应,不能用氯化钙溶液吸收二氧化硫,故D错误;本题选AB。
(3)升高温度,发现NO的分解率降低,说明反应向逆反应方向进行,该反应放热;由图可知,在n(NO)/n(CO)=1的条件下,850K时,NO还原为N2的转化率接近为100%;故答案为:NO的分解反应是放热反应,升温有利于反应逆向进行;850;
(4)由表中数据可知,C、NO、E.F的化学计量数之比为(3.0002.960):(0.100.020):0.040:0.040=1:2:1:1,反应中C被氧化,
①结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,反应方程式为C+2NON2+CO2,故答案为:C+2NON2+CO2;
②T1<T2,图表中NO随温度升高增大,说明升温平衡逆向进行,正反应为放热反应,该反应△H<0,故答案为:<;
③反应C+2NON2+CO2是一个气体体积不变的反应,而反应物只有一种,故加入NO气体,建立的平衡和原平衡为等效平衡,原平衡中NO转化率为![]() ,则达到新平衡时NO的转化率为80%,故答案为:80%。
,则达到新平衡时NO的转化率为80%,故答案为:80%。