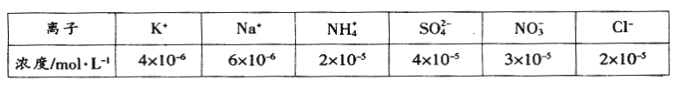
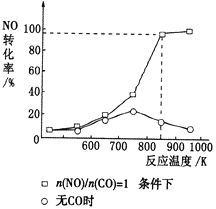
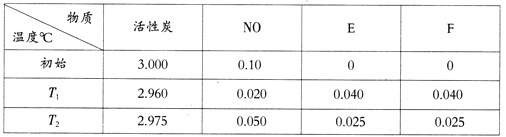
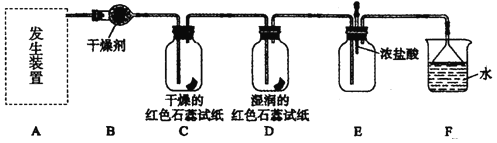
题目内容
【题目】下列物质属于非电解质的是( )
A.CO2
B.NaOH
C.NaCl
D.H2SO4
【答案】A
【解析】A.二氧化碳的水溶液能导电,但导电的是碳酸而不是二氧化碳,所以二氧化碳是非电解质,A符合题意;
B.氢氧化钠在水溶液里或熔融状态下能电离出自由移动的阴阳离子而使其水溶液或熔融状态导电,所以氢氧化钠是电解质,B不符合题意;
C.氯化钠在水溶液里或熔融状态下能电离出自由移动的阴阳离子而使其水溶液或熔融状态导电,所以氯化钠是电解质,且是强电解质,C不符合题意;
D.硫酸在水溶液里能电离出阴阳离子而使其溶液导电,所以硫酸是电解质,且是强电解质,D不符合题意;
所以答案是:A.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目