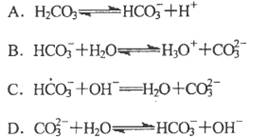
题目内容
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是( )
A.等浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HC
 )+2c(C
)+2c(C )
)
D
解析

练习册系列答案
相关题目
下列化学实验事实及其解释或结论都正确的是( )
| A.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| B.用乙醇、冰醋酸及pH=0的H2SO4加热可制乙酸乙酯,用饱和的Na2CO3溶液可以洗去其中含有的乙醇和乙酸,说明乙酸乙酯在Na2CO3溶液中的溶解度很小 |
| C.向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
| D.配制0.10mol/L NaCl溶液,俯视容量瓶的刻度线定容,所配溶液浓度偏大 |
25℃时,几种弱酸的电离常数如下:
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
25℃时,下列说法正确的是( )
A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)> pH(Na2S) > pH(NaCN)
B.a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L
蒸干FeCl3水溶液后再加强热,得到的固体物质主要是( )
| A.FeCl3 | B.FeCl3·6H2O | C.Fe(OH)3 | D.Fe2O3 |
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2 HCN+NaNO2,NaCN+HF
HCN+NaNO2,NaCN+HF HCN+NaF,NaNO2+HF
HCN+NaF,NaNO2+HF HNO2+NaF
HNO2+NaF
由此可判断下列叙述不正确的是( )
| A.K(HF)=7.2×10-4 |
| B.K(HNO2)=4.9×10-10 |
| C.根据其中两个反应即可得出结论 |
| D.K(HCN)<K(HNO2)<K(HF) |
某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是( )
A.含有大量S 的溶液中肯定不存在Ag+ 的溶液中肯定不存在Ag+ |
| B.0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀 |
| C.Ag2SO4的溶度积常数(Ksp)为1×10-3 |
| D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
下列叙述正确的是( )
| A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)=1×10-14 |
| B.c(H+)等于1×10-7 mol/L的溶液一定是中性溶液 |
| C.0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol/L CH3COOH溶液中的c(H+)的2倍 |
| D.任何浓度的溶液都可以用pH来表示其酸碱性的强弱。 |
①pH=2的CH3COOH溶液;
②pH=2的盐酸;
③pH=12的氨水;
④pH=12的NaOH溶液。
相同条件下,有关上述溶液的比较中,正确的是( )
| A.水电离的c(H+):①=②=③=④ |
| B.将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ |
| C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D.向溶液中加入100 mL水后,溶液的pH:③>④>①>② |