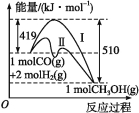
题目内容
【题目】(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是________________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为____________mol,放出的热量为____________kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH1=-574 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=____________。
(4)某氮肥厂氨氮废水中的氮元素多以NH![]() 和NH3·H2O形式存在,该废水的处理流程中,NH
和NH3·H2O形式存在,该废水的处理流程中,NH![]() 在微生物作用的条件下经过两步反应被氧化成NO
在微生物作用的条件下经过两步反应被氧化成NO![]() 。两步反应的能量变化示意如图所示:
。两步反应的能量变化示意如图所示:
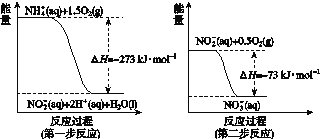
1 mol NH![]() (aq)全部氧化成NO
(aq)全部氧化成NO![]() (aq)的热化学方程式是________________。
(aq)的热化学方程式是________________。
【答案】
(1)2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH=-270 kJ·mol-1(3分)
(2)0.3;3(2a+b)/80(2分)
(3)-1160 kJ·mol-1;(2分)
(4)NH![]() (aq)+2O2(g)=NO
(aq)+2O2(g)=NO![]() (aq)+H2O(l)+2H+(aq) ΔH=-346 kJ·mol-1(3分)
(aq)+H2O(l)+2H+(aq) ΔH=-346 kJ·mol-1(3分)
【解析】(1)依据题意知,处理烟道气污染的一种方法是将CO、SO2在催化剂作用下转化为单质S,对照反应①和②,并根据盖斯定律将反应①×2-②可得2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH=-270 kJ·mol-1,故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH=-270 kJ·mol-1;
(2)假设两个反应分别为①、②,由①×2+②可得:4CO(g)+2NO2(g)===N2(g)+4CO2(g) ΔH=-(2a+b)kJ·mol-1,反应中转移电子为8e-。因此标准状况下的3.36 L CO还原NO2时,转移电子为015×2 mol=0.3 mol,放出的热量为(0.15/4)×(2a+b)kJ·mol-1=3(2a+b)/80 kJ,故答案为:0.3;3(2a+b)/80;
(3)CH4还原NO2至N2的热化学方程式为CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1,根据盖斯定律,ΔH=![]() (ΔH1+ΔH2),解得ΔH2=-867 kJ·mol-1×2-(-574 kJ·mol-1)=-1 160 kJ·mol-1,故答案为:-1160 kJ·mol-1;
(ΔH1+ΔH2),解得ΔH2=-867 kJ·mol-1×2-(-574 kJ·mol-1)=-1 160 kJ·mol-1,故答案为:-1160 kJ·mol-1;
(4)第一步反应的热化学方程式为NH![]() (aq)+1.5O2(g)===NO
(aq)+1.5O2(g)===NO![]() (aq)+H2O(l)+2H+(aq)ΔH=-273 kJ·mol-1, 第二步反应的热化学方程式为NO
(aq)+H2O(l)+2H+(aq)ΔH=-273 kJ·mol-1, 第二步反应的热化学方程式为NO![]() (aq)+0.5O2(g)===NO
(aq)+0.5O2(g)===NO![]() (aq) ΔH=-73 kJ·mol-1,两式相加得:NH
(aq) ΔH=-73 kJ·mol-1,两式相加得:NH![]() (aq)+2O2(g)===NO
(aq)+2O2(g)===NO![]() (aq)+H2O(l)+2H+(aq) ΔH=-346 kJ·mol-1,故答案为:NH
(aq)+H2O(l)+2H+(aq) ΔH=-346 kJ·mol-1,故答案为:NH![]() (aq)+2O2(g)===NO
(aq)+2O2(g)===NO![]() (aq)+H2O(l)+2H+(aq) ΔH=-346 kJ·mol-1。
(aq)+H2O(l)+2H+(aq) ΔH=-346 kJ·mol-1。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】已知H2(g)+Br2(l)=2HBr(g);△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
化学物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量/KJ | 436 | a | 369 |
则表中a为( )
A.404 B.260 C.230 D.200